根据中国医药保健品进出口商会提供的数据,2018年第一季度,中国对美国西药制剂出口额超过9000万美元。其中,TOP 5制药企业恒瑞医药、华海药业、南通联亚、人福医药以及齐鲁制药出口额合计占了制剂出口总额的67%。
在过去三年中,华海药业、恒瑞医药以及石药集团持续占据了年度制剂出口TOP 5的位置。从全球仿制药的市场来看, 欧盟、美国以及中国为全球前三大仿制药消费市场,近年来,中国本土制药企业获得的美国ANDA批准文号逐渐增多,西药制剂出口呈上涨趋势。
文号集中 制剂出口总体规模小
据报道,国内本土制药企业FDA的申报之路最早可追溯到1974年人福普克药业美索巴莫片的申报(已撤市),随后的1979年,华海药业也是通过申报美索巴莫开始了FDA的海外申报之路。
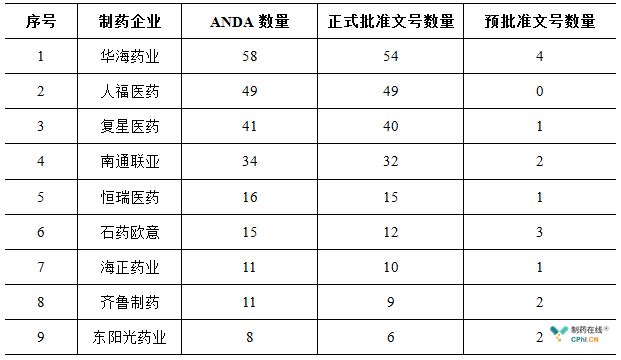
截至8月20日,中国本土制药企业拥有的美国ANDA批准文号共计278个,包括255个正式批准文号和23个预批准文号。
TOP 9制药企业拥有的文号数共计243个,集中了文号总量的87.4%,其中华海药业、人福药业以及复星医药囊括了前三甲,南通联亚、恒瑞医药分别位列第4、第5。
目前,国内的原料药和制剂生产企业超过4000家,拥有的药品批准文号近17万个,其中的95%以上均为仿制药,包括了西药仿制药和中药仿制药。与之相比,278个美国ANDA批准文号涉及到的国内制药企业数量尚不足40家。
2017年,国内制药企业对美国西药制剂的出口额为3.1亿美元,占西药制剂出口总额的份额不足9%,同年,我国西药原料药的出口总额为291.17亿美元,2015年与2016年的情况类似,在我国西药出口产品中,西药原料药依然是主要产品,西药制剂的规模小。
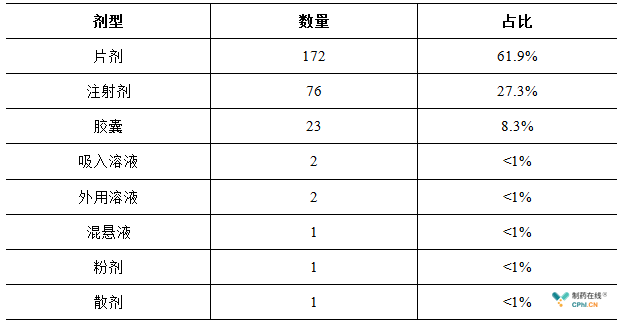
278个ANDA文号覆盖了216个剂型品种,其中片剂的占比超过60%,注射剂占比为27.3%,吸入溶液、外用溶液、混悬液、粉剂以及散剂的占比均小于1%。总体而言,对美国出口制剂品种的剂型种类少。
FDA鼓励仿制药申报 未来竞争加剧
2017年,FDA共收到了1306个仿制药申请,批准的ANDA数量为767个。据观察,近年来FDA在大力鼓励仿制药的申报,对仿制药ANDA的审评持续提速;另外,已获批产品的类型大多数都属于已有同类仿制药的竞品。
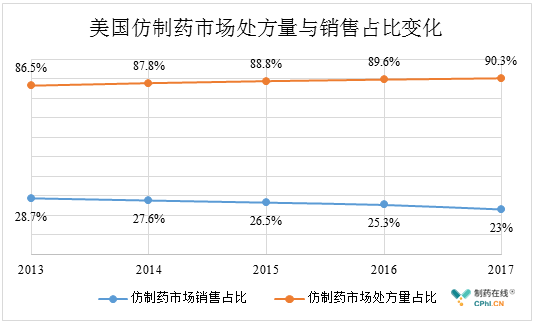
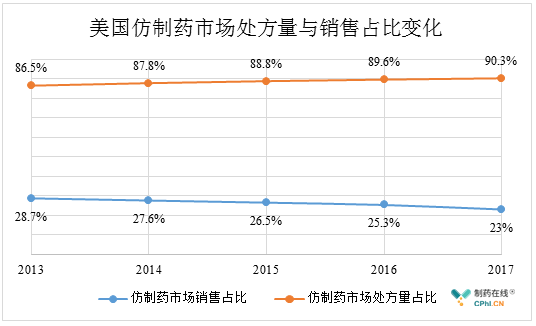
未来,多款竞品同时存在的美国市场,竞争将进一步加剧,市场价格将被新入者持续拉低,仿制药的价格走低将是大趋势,这一点从过去5年中仿制药处方量和销售占比的消长变化中可以体现出来:从2013年至2017年,美国市场仿制药的处方量占比从86.5%逐步上升至90.3%,相反的是,仿制药的市场销售占比从28.7%一路下降至23%。这其中涉及到了多种因素的影响,仿制药价格走低无疑是其中的重要因素。
2个首仿+1个专利挑战成功品种
对于大部分不断有后来者进入的仿制药品种领域,竞争的加剧势必无可避免,然而对于首仿药或者专利挑战成功的品种,可以凭借美国市场现行政策享受到市场独占期,进而获得可观利润。
成功获批首仿的药物在原研药物专利到期的当天就可以销售,同时拥有为期180天的市场独占期;专利挑战成功的仿制药可以获得独家的市场独占期。无论哪种情形,处于市场独占期内的仿制药都拥有优势的市场定价权以及销售预期。
2014年11月,恒瑞医药生产的注射用环磷酰胺USP(美国药典标准)首仿药获得FDA批准正式在美国市场销售。2017年,恒瑞医药制剂国家化的海外收益为6.37亿元,这一业绩的主要贡献来源于美国市场获批的这款首仿药物。今年2月,恒瑞医药吸入用地氟烷ANDA申请获得FDA批准,这是继环磷酰胺之后在美国上市的第2个首仿药。这两款首仿药物的获批对恒瑞医药未来国际化业绩的增长有着不同寻常的意义。
除了两个首仿药之外,2017年8月21日,华海药业的帕罗西汀胶囊正式获得FDA批准,成为我国第一个PIV专利挑战成功的仿制药。帕罗西汀胶囊通过专利挑战获批,取得美国市场的首仿药资格,不仅仅可为华海赢得可观利润,也为华海后续产品的上市提供了重要的技术支撑。
作者简介:小药丸,制药行业从业者,自媒体时代的文字搬运工,专注于制药圈内的阴晴冷暖。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57