近日,医药圈又有一个重磅消息,Keytruda(K药)即将在中国获批第三个适应症,用于PD-L1阳性非小细胞肺癌(NSCLC)的一线治疗。
根据NMPA官网显示,默沙东PD-1单抗新适应症上市申请(受理号:JXSS1800029)的办理状态已经变更为"在审批",该适应症大概率将在10月份获批。
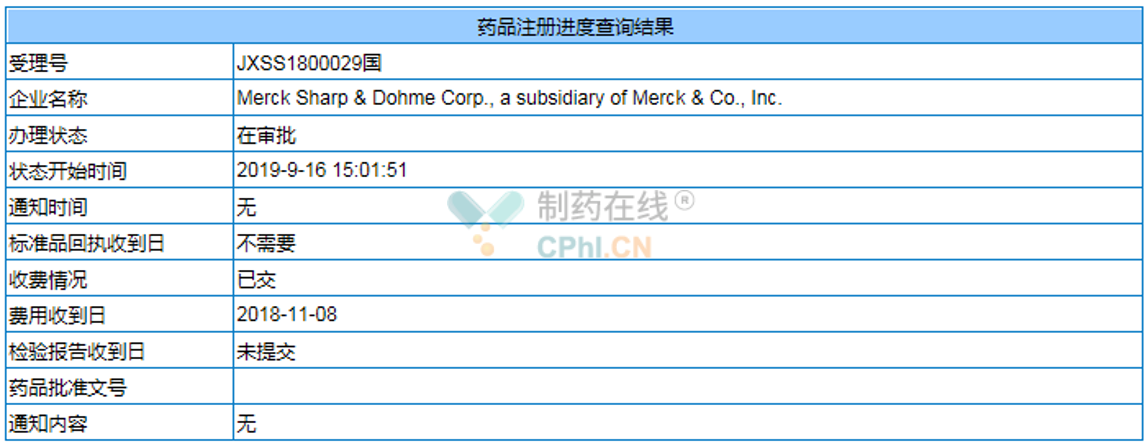
(资料来源于NMPA官网)
此前K药已有两个适应症在国内获批
2018年7月26日,帕博利珠单抗(Pembrolizumab,商品名:Keytruda/可瑞达)获NMPA批准上市(受理号:JXSS1800002),用于后疾病发生进展的局部晚期或转移性黑色素瘤患者的二线治疗;
2019年4月2日,K药第二个适应症上市申请(受理号:JXSS1800018)获批准,联合培美曲塞、顺铂一线治疗EGFR和ALK阴性的转移性非鳞状非小细胞肺癌(NSCLC)。
Keytruda是国内首个进入一线治疗的PD-1/PD-L1单抗,目前全球仅有默沙东的Keytruda与罗氏的Tecentriq获批NSCLC的一线疗法,后者在国内尚处于申报注册中。
K药在美国获批一线治疗PD-L1高低表达NSCLC患者
2016年10月24日,FDA批准Keytruda,用于一线治疗PD-L1表达强阳性(Tumor Proportion Score,即TPS≥50%)且EGFR和ALK突变均为阴性的转移性NSCLC患者。
此次获批是基于一项名为"KEYNOTE-024"的研究,KEYNOTE-024研究是一项Ⅲ期随机研究,要求PD-L1表达≥50%,研究对比了帕博利珠单抗和含铂双药化疗。
KEYNOTE-024研究中OS结果
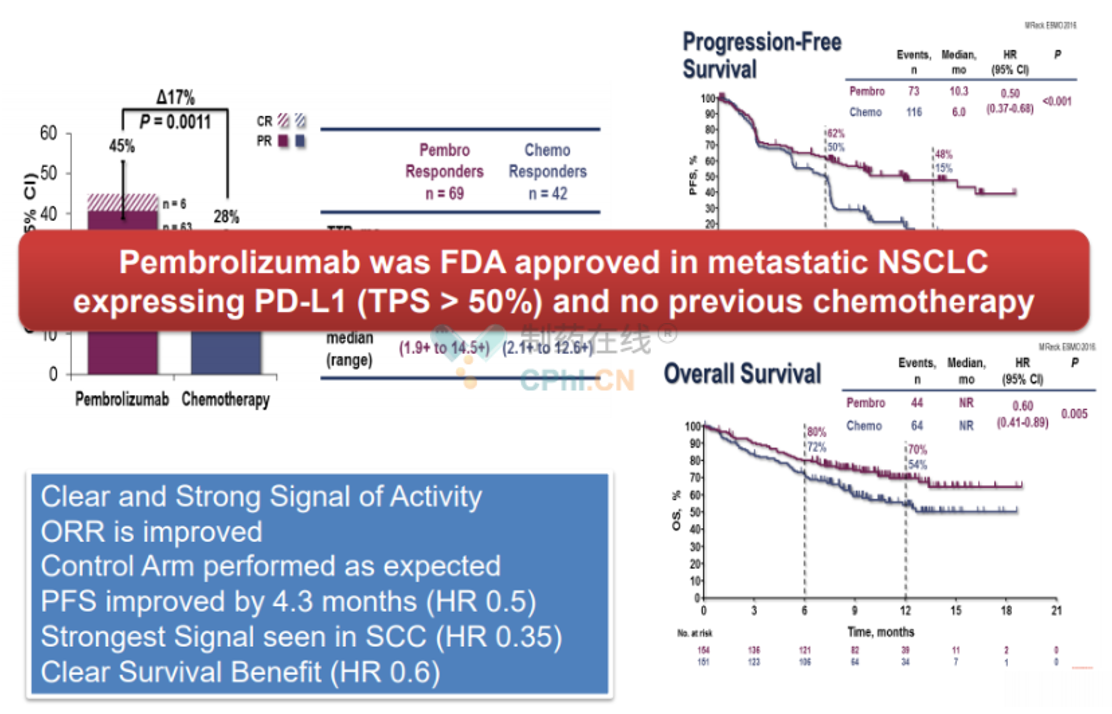
(资料来源:The Lancet)
结果显示,Keytruda的PFS和OS均显著优于化疗,mPFS为10.3vs6.0个月;mOS为30.0vs14.2个月。这些数据表明,对于PD-L1表达强阳性的晚期NSCLC患者,与基于铂类的标准化疗相比,K药治疗可以显著延长PFS和总生存期。
2019年4月11日,FDA批准Keytruda用于单药一线治疗PD-L1(TPS≥1%)且无EGFR和ALK突变的III期或转移性NSCLC患者。
此次获批是基于KEYNOTE-042研究,KEYNOTE-042是一项全球、随机、开放标签的Ⅲ期试验,试验入组了1274例PD-L1TPS评分≥1%的晚期NSCLC(包括非鳞状和鳞状组织学类型)患者,其中,47%的患者PD-L1TPS≥50%;64%的患者PD-L1TPS≥20%。评估了Keytruda作为单药疗法用于一线治疗时相对于含铂化疗的疗效和安全性。该研究中,入组的患者不存在EGFR或ALK肿瘤基因组畸变,且之前未接受系统疗法治疗晚期疾病。研究的首要评估终点是PD-L1不同表达(TPS≥50%,TPS≥20%,和TPS≥1%)人群的总生存期(OS),按PD-L1表达分层依次进行,次要终点是无进展生存期(PFS)和客观缓解率(ORR),评估也是按PD-L1表达分层依次按顺序进行。
从主要终点OS来看,具体结果如下:

(资料来源:The Lancet)
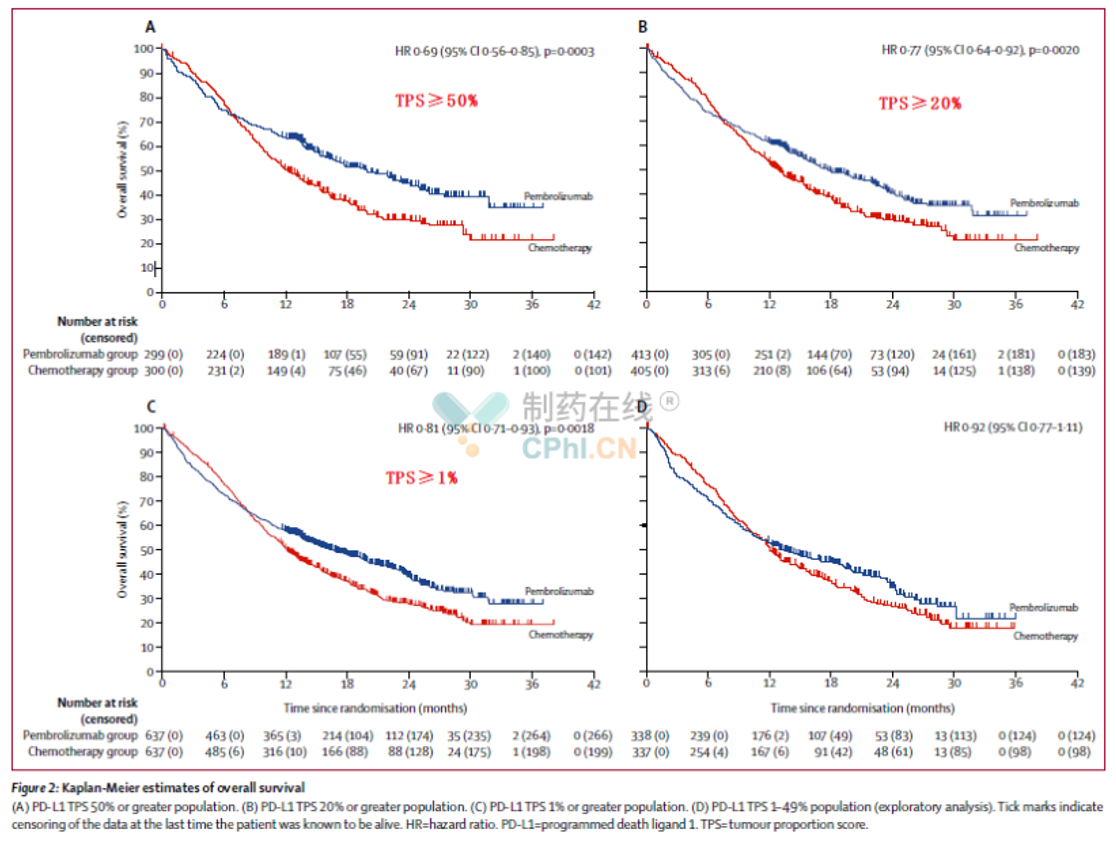
(资料来源:The Lancet)
此次在中国获批的到底是哪种PD-L1阳性NSCLC,高表达还是低表达?有知情者欢迎留言讨论。
K药在中国开展多项临床试验
除了黑色素瘤以及NSCLC,Keytruda还在中国开展了胃癌、食管癌以及乳腺癌等多项临床试验。
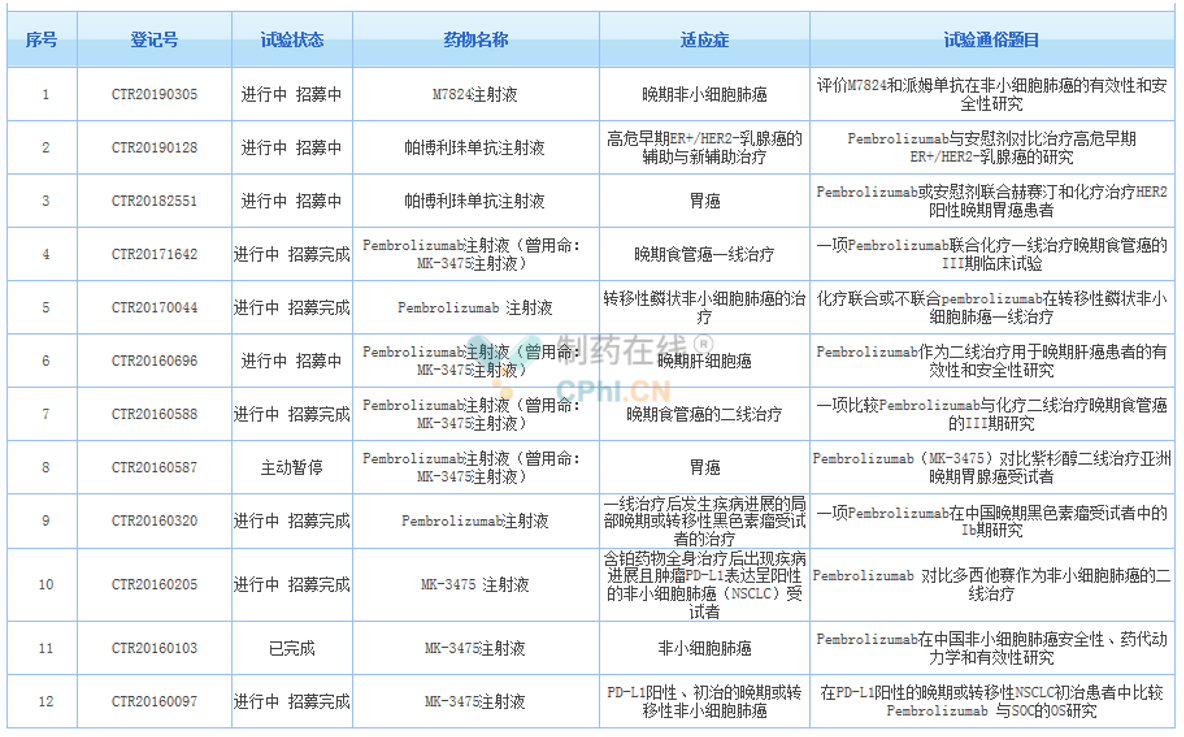
(资料来源:药物临床试验登记与信息公示平台)
K药在中国售价价格
2018年9月20日,Keytruda正式在华销售,定价为17918元/100mg。(Keytruda恶黑适应症2018年11月被纳入深圳医保,Keytruda肺癌适应症于2019年5月进入珠海补充医保)
K药的适应症开发路径
自2014年最早获得黑色素瘤适应症以来,5年内K药已经在11个瘤种中取得了适应症的批准,参考有关的临床开发进度,预计未来1-2年K药有望继续在三阴性乳腺癌、肾癌等适应症继续取得突破。按照默沙东的开发计划,K药最终有望在超过15种肿瘤中实现适应症的获批,从高发肿瘤逐渐向小瘤种和罕见瘤种推进。
K药适应症开发路径
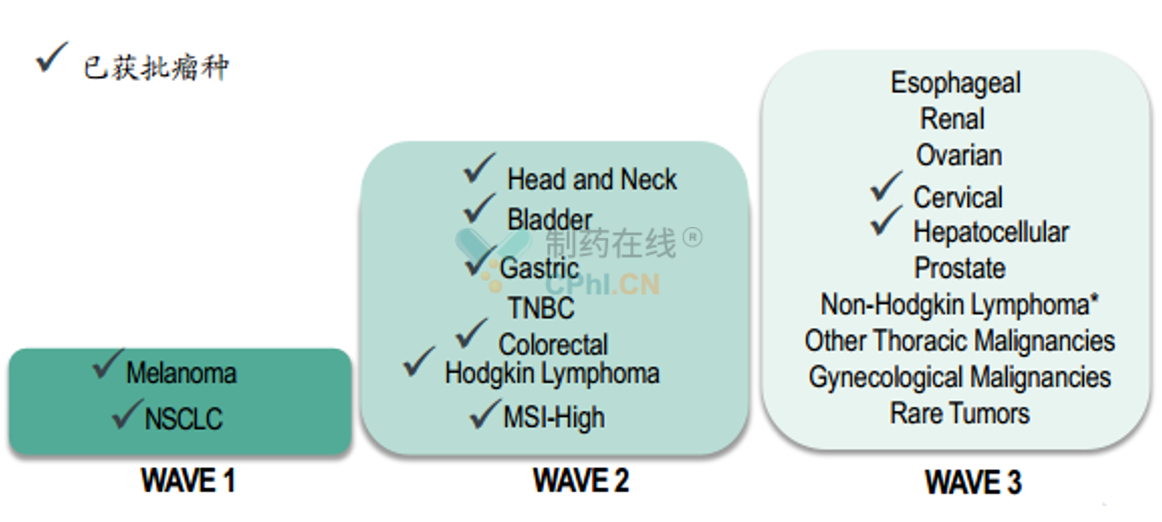
(资料来源:MSD官网)
国内已上市及已报产的PD-1/PD-L1单抗
2018年6月,BMS的Opdivo(俗称O药)获NMPA批准,是第一个在中国上市的PD-1/PD-L1单抗,开启了国内免疫治疗时代。
2018年8月,K药获批;12月份,君实的特瑞普利和信达的信迪利也已获得批准;2019年5月,恒瑞的卡瑞利珠单抗获得批准。自2018年下半年到19年初,阿斯利康的Durvalumab、百济神州的替雷利珠单抗和罗氏的Atezolizumab也先后提交了上市申请。
国内已上市及已报产的PD-1/PD-L1单抗
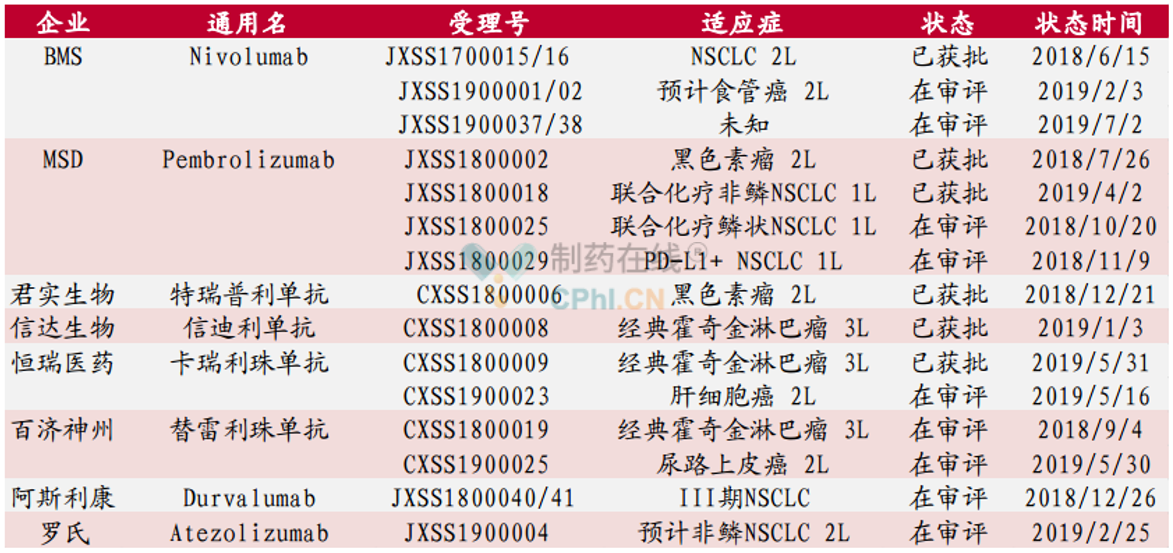
(资料来源:CDE)
作者简介:菜菜,上海交通大学药学硕士,曾工作于科学技术情报研究所,现为药监系统从业人员,擅长解读行业法规、最新药研动态等。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57