近日,赛诺菲国内提交了在研新药SAR442168的三项临床申请,系在中国的首次申报临床,已获得CDE的受理承办。
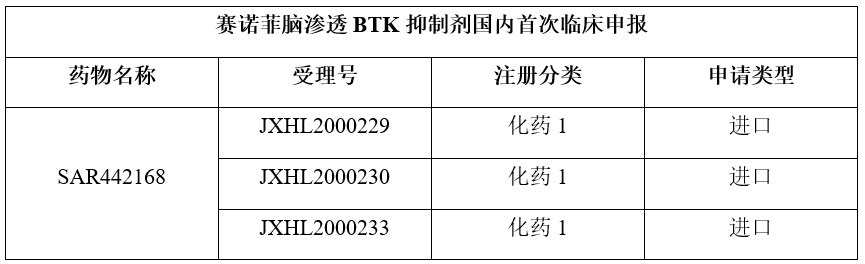
资料来源:CDE
首次中国临床申报
研究发现,布鲁顿氏酪氨酸激酶(BTK)对包括B淋巴细胞和巨噬细胞等在内的各种免疫细胞的发育和功能都具有重要的作用,通过抑制BTK激酶,可以实现调节与大脑和脊髓神经炎症相关的适应性和先天性免疫细胞的目的。
SAR442168是一款口服、脑渗透性、选择性、小分子布鲁顿酪氨酸激酶(BTK)抑制剂,值得一提的是,此次为该产品在中国首次申报临床,赛诺菲积极布局中国的多发性硬化症(MS)治疗市场。
总部位于美国旧金山的Principia Biopharma是一家专注于研发多发性硬化症和一系列自身免疫性疾病治疗药物的公司,重点包括开发免疫介导疾病的治疗方法。SAR442168最早由Principia Biopharma开发,赛诺菲通过前者的授权获得了SAR442168的开发和商业化的全球权利。
IIb期研究达到了主要终点和次要终点
在早期的I期临床试验中,SAR442168显示出了BTK结合以及渗透血脑屏障的能力。
今年4月底,SAR442168用于复发型多发性硬化症(RMS)的治疗的IIb期研究达到了主要终点和次要终点。
在4种剂量为期12周的治疗周期中,磁共振成像(MRI)结果显示,SAR442168能够显著降低与多发性硬化症(MS)相关的疾病活动性,新的钆(Gd)增强T1和新的或扩大的T2高信号病变的数量相对减少≥85%;同时在这项研究中,患者耐受性良好,没有新的安全性发现。
基于这项临床研究的积极结果,这款脑渗透性BTK抑制剂在降低多发性硬化症(MS)患者神经炎症和神经退行性病变方面崭露头角,有潜力成为解决大脑中多发性硬化症(MS)损伤来源的第一个疾病修饰疗法。
拟收购获得SAR442168的完全权益
为了加强赛诺菲在自身免疫性和过敏性疾病等领域的产品开发能力,8月中旬,赛诺菲发布消息,将以34亿美元的现金收购Principia Biopharma,这笔交易预计将在今年第四季度完成。通过这笔收购交易,赛诺菲将能够获得脑渗透性BTK抑制剂SAR442168完全权益。
临床布局
绝大多数多发性硬化症(MS)患者在疾病过程中将会经历残疾。与传统的多发性硬化症(MS)治疗药物不同,小分子BTK抑制剂SAR442168不仅能抑制外周免疫系统,而且还穿过血脑屏障,抑制迁移到大脑的免疫细胞,同时也调节与多发性硬化进展有关的脑内微胶质细胞,有潜力改变多发性硬化症(MS)患者未来的治疗方式。
在Clinicaltrials临床研究信息中,SAR442168共登记了7项临床试验,其中两项已完成;2020年以来,赛诺菲新启动了4项III期临床研究,适应症包括复发性多发性硬化症(RMS)、继发性进行性多发性硬化症(SPMS)、原发性进行性多发性硬化症等(PPMS),旨在探索SAR442168对多发性硬化症复发率、残疾进展、潜在中枢神经系统损害的影响。
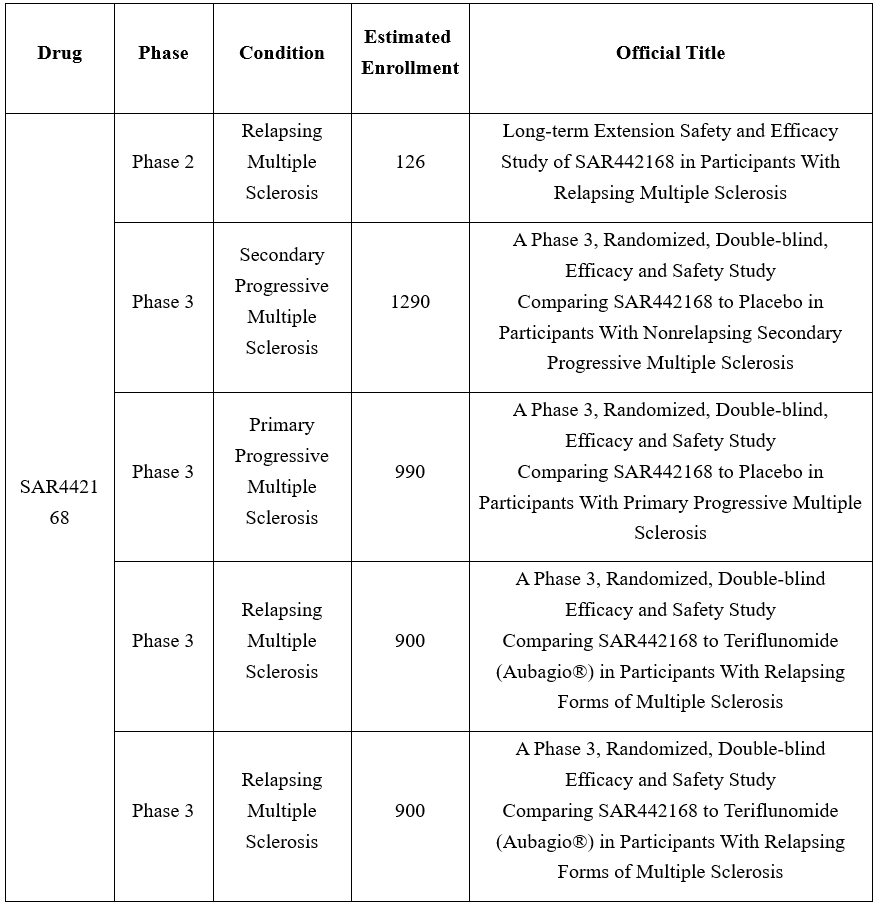
资料来源:Clinicaltrials



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57