当地时间2月28日,传奇生物在美国新泽西州萨默塞特正式宣布,其自主研发的BCMA靶向CAR-T疗法——西达基奥仑赛(英文商品名:CARVYKTI®,英文通用名ciltacabtagene autoleucel,简称Cilta-cel)获得美国FDA批准上市, 用于治疗成人复发或难治性多发性骨髓瘤(R/R MM)患者,这些患者既往接受过四种或四种以上的治疗,包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体。这是首 款在美国获批上市的中国原创CAR-T药物,代表了中国创新药国际化的新高度。
在国外,该药的生物制剂许可证申请(BLA) 由传奇生物合作伙伴杨森公司提交。2021 年 5 月,美国 FDA 受理西达基奥仑赛BLA 申请,并给予优先审评资格,PDUFA 日期为 11 月 29 日;11 月初,传奇生物宣布 FDA 将审评时间延迟到了 2 月 28 日,今日终于获批。
多发性骨髓瘤与BCMA靶点
多发性骨髓瘤(Multiple Myeloma, MM)是骨髓中的浆细胞恶性增殖引起的一种恶性肿瘤,被认为是不可治愈的血液肿瘤。据美国癌症协会估计,2022年美国将有超过34000人被诊断为多发性骨髓瘤,超过12000人因此死亡。虽然有些多发性骨髓瘤患者无明显症状,但大多数患者是由于出现症状而被确诊,这些症状可能包括骨病、低血细胞计数异常、血钙升高、肾 脏问题或感染等。虽然经过治疗可能会有一些缓解,但不幸的是,患者很可能会复发。使用标准疗法(包括蛋白酶抑制剂、免疫调节剂和抗CD38单克隆抗体)治疗后复发的患者会面临预后不佳,治疗手段受限的问题。
BCMA(B细胞成熟抗原)是一种跨膜糖蛋白,它属于肿瘤坏死因子(TNF)受体超家族,又被称为TNFRSF17或CD269。研究显示,BCMA在B细胞的增殖和存活中起关键作用,主要在浆细胞和成熟B淋巴细胞中表达。目前,科学证据已表明,BCMA在多发性骨髓瘤中存在过度表达,并呈现随着疾病加重而表达增加的特点,因此,BCMA可谓是治疗多发性骨髓瘤的理想靶点。
西达基奥仑赛(Cilta-cel)是靶向BCMA的定向嵌合抗原受体T细胞(CAR-T)疗法,该疗法含有4-1BB共刺激结构域和两个BCMA靶向单域抗体,旨在增加其靶向癌细胞的综合能力。
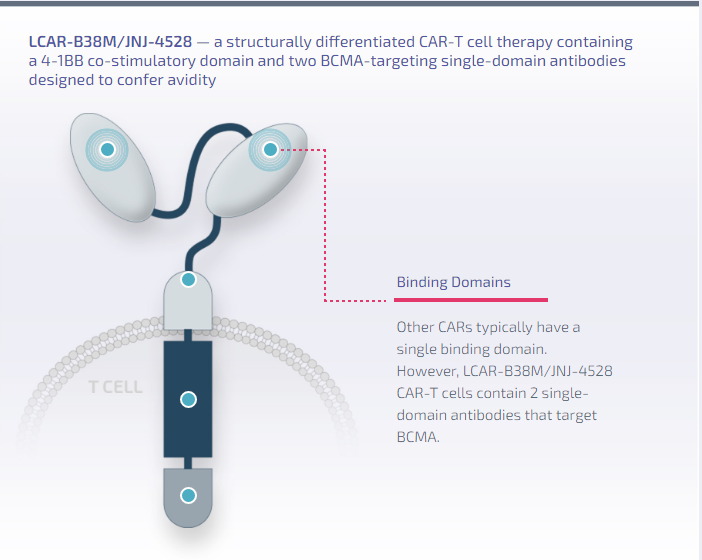
Cilta-cel结构(来源:传奇生物官网)
西达基奥仑赛(Cilta-cel)临床数据亮眼
FDA此次批准是基于一项关键性Ib/II期CARTITUDE-1研究结果,该研究评估了cilta-cel在复发/难治性多发性骨髓瘤患者中的疗效和安全性。
招募的97例受试者中,99%接受末线治疗无效,其中88%既往接受过包括免疫调节剂、蛋白酶体抑制剂、抗CD-38抗体至少3线治疗后无应答。研究结果显示,中位随访12.4个月时,独立委员审查的客观缓解率(ORR)为97%,包括67%的sCR(严格的完全缓解),92.8%的患者获得了非常好的部分缓解(VGPR)及以上。≥3级细胞因子综合征(CRS)发生率为4%,≥3级神经**发生率为9%。
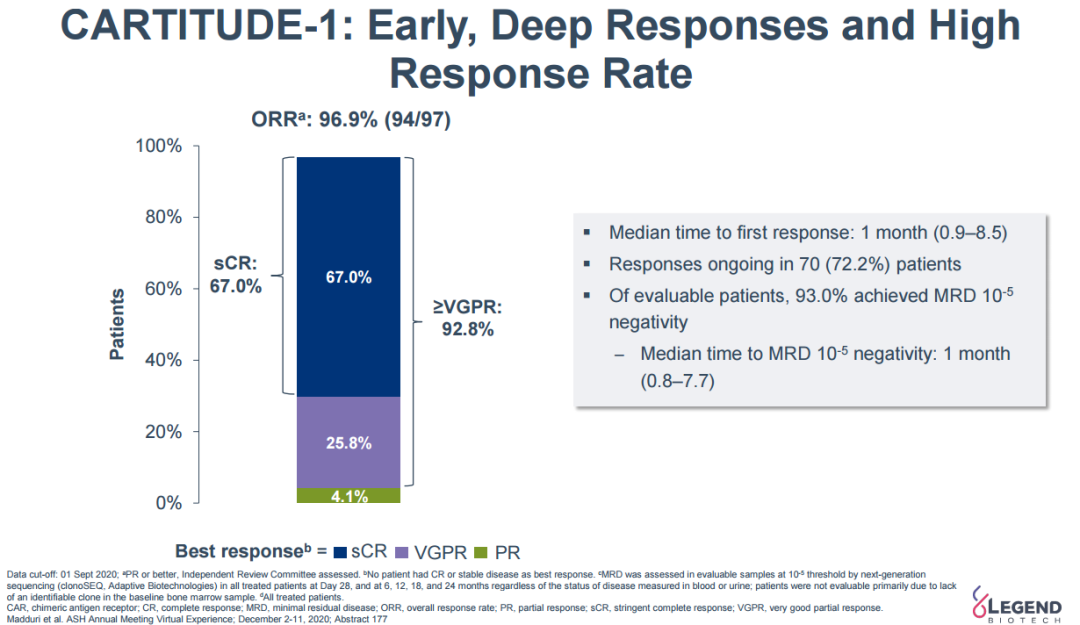
CARTITUDE-1研究12.4个月随访数据(传奇生物官网)
最新一次的2021年ASCO年会上,传奇更新的CARTITUDE-1研究的18个月中位随访数据显示,接受西达基奥仑赛治疗患者的ORR达到97.9%。
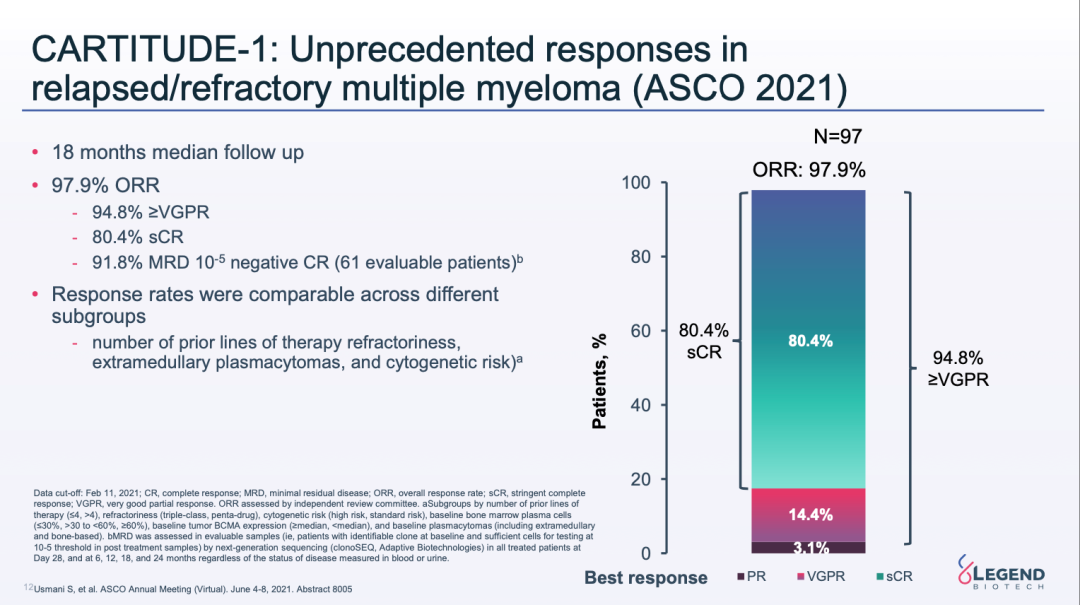
CARTITUDE-1研究18个月随访数据(来源:2021ASCO)
CARTITUDE-2研究队列A初步数据显示,既往接受过一到三线治疗的MM患者的ORR为95%,其中75%达到sCR/CR。
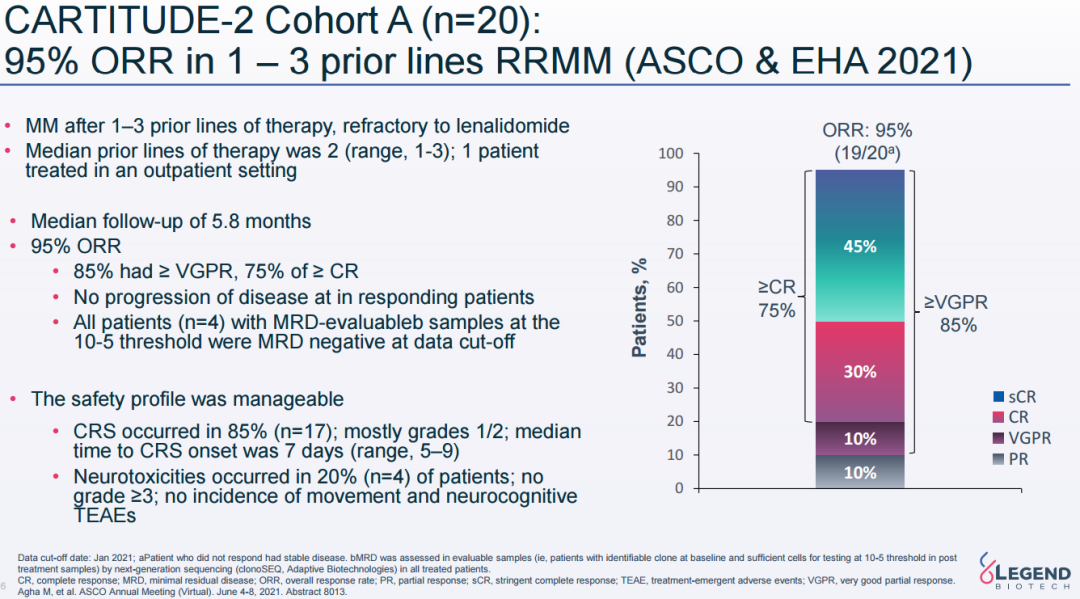
CARTITUDE-2研究随访数据(来源:2021ASCO)
与其他同类CAR-T产品相比,西达基奥仑赛不但具有独特药物结构,而且临床用药剂量明显更小,使用安全性高而疗效却极为优异。
西达基奥仑赛(cilta-cel)获多项认定
西达基奥仑赛于2018年获得国家药品监督管理局的首 个CAR-T临床试验申请(IND)批件,并于同年获得美国FDA的IND批准,随后获得FDA突破性疗法和孤儿药认定,于2019年获得欧洲药品管理局优先药物认定(PRIME)资格及美国FDA授予的突破性疗法认定,2020年8月,又获中国首 个“突破性疗法”资格认证。2020年12月,传奇生物向FDA滚动递交cilta-cel的BLA。同月,杨森又向日本厚生劳动省提交了cilta-cel的新药申请(NDA)。
西达基奥仑赛(cilta-cel)市场前景
目前已上市和在研的 CAR-T 疗法在 CD19 靶点上扎堆较为严重。BCMA 次之,但竞争相对更轻。目前,全球已有7款CAR-T治疗产品上市,分别为诺华Kymriah、吉利德子公司Kite的Yescarta与Tecartus、百时美施贵宝Breyanzi、新基Celgene的 Abecma,以及国内获批上市的复星凯特的阿基仑赛注射液以及药明巨诺的瑞基奥仑赛注射液。
2021年3月,百时美施贵宝(BMS)和蓝鸟生物带来的Abecma获得FDA批准,抢先一步成为全球首 款靶向BCMA的CAR-T细胞疗法。Abecma定价为41.95万美元,其首年销售成绩已经出炉,高达 1.64 亿美元,约为同期获批的 CAR-T 产品的两倍之高,另据弗若斯特沙利文报告,2024年全球CAR-T疗法市场规模有望达到66亿美元,2030年达到218亿美元,全球CAR-T市场还未饱和。而cilta-cel作为全球第二款获批上市的靶向BCMA的CAR-T疗法,其上之后最直接的竞争对手——Abecma,该产品的销售额对cilta-cel存在一定的参考价值,
如今,传奇生物西达基奥仑赛(cilta-cel)即将迎来收获期,为多发性骨髓瘤患者带来更多治疗选择,带动传奇生物实现商业化第一步。据悉,西达基奥仑赛定价为46.5 万美元,如若不出意外,其获批上市将为传奇生物带来切实的业绩提振与值得期待的利润空间。
国内BCMA CAR-T疗法布局
目前,这一疗法在国内外企业中均有布局,在国内,进行BCMA CAR-T疗法研发的药企进展都较为顺畅,除传奇生物获批外,科济药业、信达生物/驯鹿医疗、亘喜生物、恒润达生等企业的临床研究进展靠前。
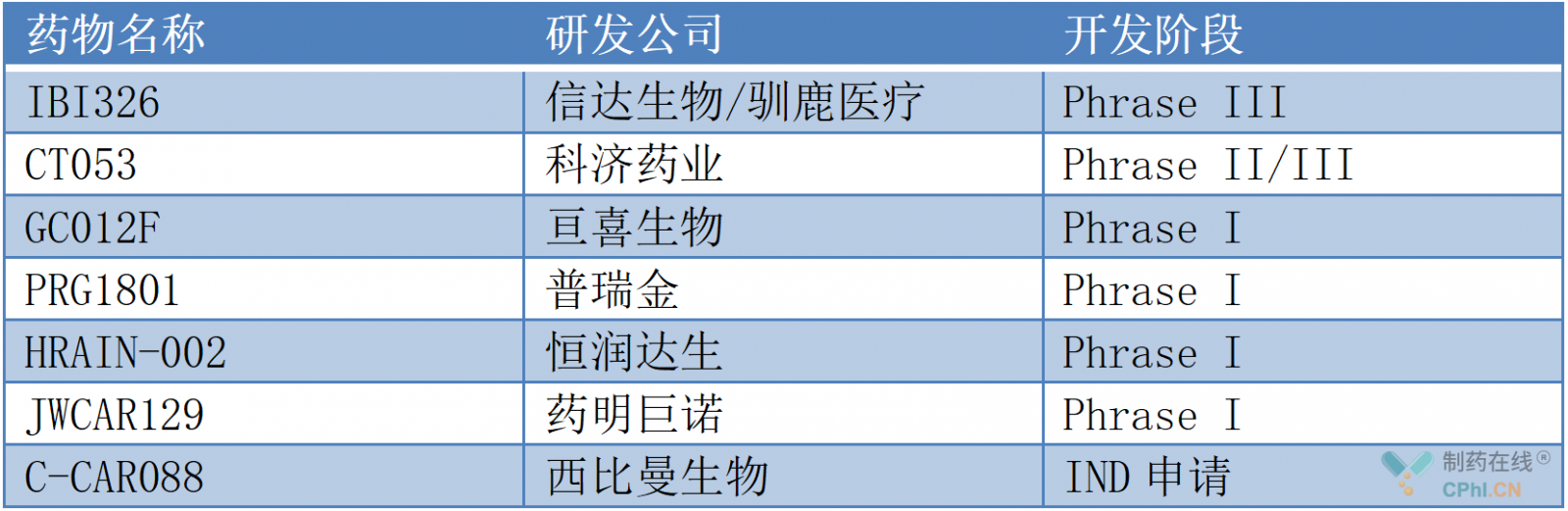
国内部分BCMA CAR-T疗法研发企业(根据公开资料整理)
目前传奇生物不仅在全球方面和杨森合作向美国 FDA、欧盟 EMA、日本 PMDA 都递交了上市申请,在中国也即将申报上市。根据此前企业披露的信息,计划于 2022 年初向 CDE 提交上市申请。而且西达基奥仑赛已被CDE纳入突破性疗法目录,这也意味着该药物将在国内加速获批。除了西达基奥仑赛,传奇生物管线中还有8款CAR-T细胞疗法已进入临床阶段,期待传奇生物的下一次突破。
参考:
1.https://www1.hkexnews.hk/listedco/listconews/sehk/2022/0301/2022030100146_c.pdf;
2.传奇生物官网。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57