国家药监局药品审评中心(CDE)官网显示,南京北恒生物科技有限公司(简称北恒生物)自主研发的CTA101 UCAR-T细胞注射液产品正式获得国家药品监督管理局(NMPA)的临床试验默示许可。CTA101是CDE批准的国内首 款"现货型"UCAR-T(通用型CAR-T)细胞治疗产品,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(R/R B-ALL)。
CTA101是北恒生物自主研发,具有独立知识产权的CTA101细胞注射液。是国内首 个基于CRISPR基因编辑技术的免疫细胞治疗产品,是国内第一个 UCAR-T创新药。
开发通用型CAR-T(UCAR-T)的必要性
CAR-T疗法全称为嵌合抗原受体T细胞免疫疗法,其主要原理是,从癌症病人身上分离免疫T细胞,利用基因工程技术为T细胞引入一个能够识别肿瘤细胞并同时激活T细胞的嵌合抗体,然后将扩增好的CAR-T细胞回输到病人体内。
CAR-T细胞疗法在血液肿瘤中表现优异,目前全球已有7款产品上市。已上市的CAR-T产品均属于自体细胞疗法,即利用患者自身的T细胞来进行个体化治疗,因此治疗过程中存在一些困难和挑战:较长的制备时间可能导致患者因疾病进展而无法回输T细胞,增加治疗风险;较高的制备失败率以及部分患者T细胞水平过低也可能影响患者的治疗结局;此外,个体化制备也导致目前CAR-T产品的价格相对昂贵。由于这些局限性,同种异体(Allogeneic)或现货型(off-the-shelf)CAR-T细胞疗法即UCAR-T成了目前重要的研究方向。
UCAR-T不需要依据患者进行相应修饰,而是直接将来源于非患者供体的T细胞进行工程化,以工业级的标准提前制备,用于大量的患者群体,做到通用化。
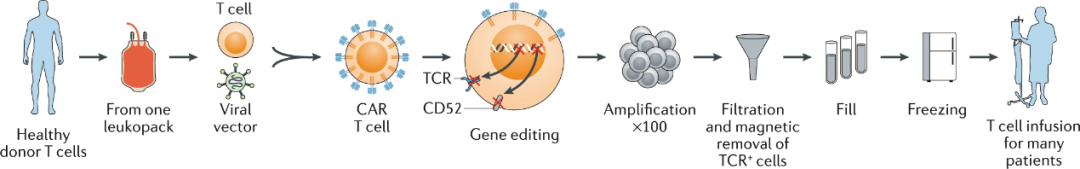
UCAR-T制备流程(图片来源:BING)
相比自体CAR-T,UCAR-T具有抗肿瘤活性高、成本低和可及性高等优势。通用型免疫细胞治疗无需配型,"现货"存储,即时使用,显著降低病人治疗周期,一位健康捐献者可制备成百上千人份"现货",可显著降低细胞治疗成本。有望从根本上解决当前CAR-T治疗成本高、时间久、生产难、个性化的困境,实现免疫细胞治疗的可负担性和可及性,被称为细胞疗法的下一代革命。因此,吸引了诸多公司加入这条新兴赛道。
在全球UCAR-T技术开发队伍中,已经涌现了一批代表企业:
Cellectis--UCAR-T19等
Cellectis公司开发了基于TALEN基因编辑技术的UCAR-T技术平台,公司基于该平台的UCAR-T产品一直处于该领域全球临床进展的领 先水平,已有6款UCAR-T细胞疗法获批临床(其中包括合作项目):UCAR-T19、UCAR-T22、UCAR-TCS1、UCAR-T123、ALLO-501、ALLO-715。
Allogene--ALLO-501A
ALLO-501 是 Allogene 公司研发的抗 CD19 UCAR-T 治疗药物,可以识别 B 细胞(包括癌性 B 细胞)上表达的一种细胞表面蛋白 CD19。2021 ASCO 上公布了ALPHA2研究结果,这是一项针对ALLO-501A 开展的单臂、开放标签、II期研究,用于复发/难治性大B细胞淋巴瘤治疗。
截止 2021 年 1 月 15 日,共入组了 11 例患者。结果显示,最常见的 AE 是贫血、白细胞减少、中性粒细胞减少和血小板减少 (73%);和淋巴细胞减少症(64%)。没有报告 GVHD(移植物抗宿主病) 或 ICANS(神经**综合征)。
CRISPR Therapeutics--CTX110
CTX110是一款利用CRISPR基因编辑技术改造的UCAR-T细胞疗法,将靶向CD19抗原的嵌合抗原受体定位敲入细胞的天然T细胞受体位点,同时使用CRISPR技术消除TCR,防止移植物抗宿主病(GvHD)的产生。针对UCAR-T细胞难以在患者体内长时间留存的问题,CRISPR Therapeutics使用CRISPR消除了在CAR-T细胞表面表达的MHC I,降低患者自身T细胞对CAR-T细胞的排斥。
在I期临床试验CARBON中,总计26例大B细胞淋巴瘤患者接受了CTX110的治疗,随访至少28天。试验结果显示,在接受剂量超过10^8个细胞的CTX110治疗的患者中,基于意向治疗分析的总缓解率为58%,完全缓解率为38%。接受治疗6个月后,完全缓解率为21%,最长的缓解持续时间超过18个月,这显示了CTX110具有持久的缓解潜力。同时,数据显示各类型患者均有应答,包括难治性患者、巨大肿块患者或既往自体干细胞移植后疾病进展患者。
Precision BioSciences--PBCAR0191
PBCAR0191是Precision BioSciences基于专有的ARCUS?基因组编辑平台研发的一种抗CD19 UCAR-T 细胞疗法。在2021年ASCO 年会上报告了 PBCAR0191治疗非霍奇金淋巴瘤(NHL) 队列的结果。
在 CAR-T 细胞治疗前接受强化高剂量淋巴清除方案的 9 例NHL患者中,ORR达到 89%,其中 7 例患者 (78%) 在输注后第 28 天达到完全缓解。此外,队列中未出现 GVHD 病例。
国外在通用CAR-T领域起步较早,但在当前国内CAR-T细胞疗法蓬勃发展的背景下,也涌现出了为数不多的UCAR-T玩家,除了前面提到的北恒生物外,还有亘喜生物、邦耀生物、茂行生物、隆耀生物等。
目前,自体CAR-T技术已经相对成熟,但对于其面临局限和挑战,UCAR-T疗法被寄予了厚望,成为了当细胞疗法研究的一个热门方向,同时也是未来细胞治疗发展的重点方向。
但通用CAR-T细胞的制备技术相对复杂,技术壁垒也相对较高。另外,其安全性也一直是研发界关注的焦点,目前通用CAR-T最 大的挑战还是在于要克服GVHD和受体对异基因T细胞的排斥反应,另外,在众多通用CAR-T细胞中应用的创新基因编辑技术也还需要更多的研究和理论来支持。
参考:
1.https://www.biospace.com/article/releases/cellectis-presents-first-preclinical-data-on-ucartmeso-an-allogeneic-car-t-cell-product-candidate-targeting-mesothelin-to-treat-solid-tumors-at-the-annual-meeting-of-the-society-for-immunotherapy-of-cancer/.
2.Bijal S, et al. Abstract 7516. Presented at: ASCO Annual Meeting (virtual meeting); June 4-8, 2021.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57