10月9日,恒瑞医药1类新药马来酸吡咯替尼片(规格:80mg、160mg)新适应症提交上市申请并获受理,联合曲妥珠单抗和多西他赛一线治疗HER2(人表皮生长因子受体2)阳性复发/转移性乳腺癌。此前,马来酸吡咯替尼片已经获批两个适应症。
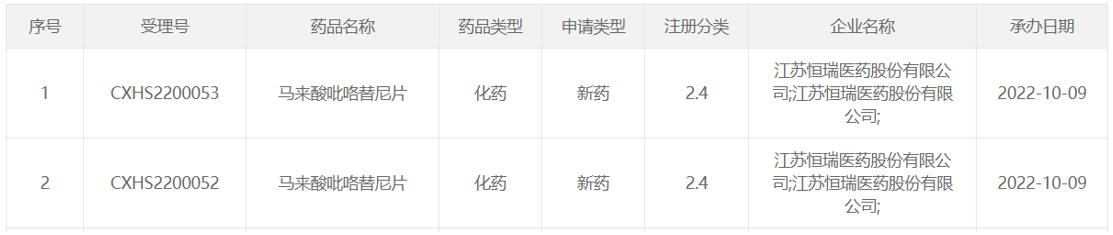
(资料来源:CDE官网)
此次该适应症申报上市是基于一项III期临床研究(HR-BLTN-III-MBC-C研究)。
一线治疗乳腺癌达到预设终点
2022年8月1日,恒瑞医药发布公告,马来酸吡咯替尼片联合曲妥珠单抗和多西他赛一线治疗HER2(人表皮生长因子受体2)阳性复发/转移性乳腺癌的随机、双盲、平行对照、多中心的III期临床研究(HR-BLTN-III-MBC-C研究),在开展方案预设的期中分析时,由独立数据监查委员会(IDMC)判定主要研究终点-无进展生存期(PFS)达到方案预设的优效标准。
研究结果表明,对于复发/转移阶段未接受过任何系统抗肿瘤治疗的HER2阳性乳腺癌患者,接受马来酸吡咯替尼片联合曲妥珠单抗和多西他赛治疗对比安慰剂联合曲妥珠单抗和多西他赛治疗,可显著延长患者的无进展生存期(PFS)。
HR-BLTN-III-MBC-C研究是一项评价马来酸吡咯替尼片联合曲妥珠单抗和多西他赛对比安慰剂联合曲妥珠单抗和多西他赛一线治疗HER2阳性复发/转移性乳腺癌的随机、双盲、平行对照、多中心的III期临床研究(登记号:NCT03863223),由中国医学科学院肿瘤医院徐兵河院士担任主要研究者,全国40家中心共同参与。
恒瑞原创1类新药已获批两项适应症
吡咯替尼是一种小分子、不可逆、泛ErbB受体酪氨酸激酶抑制剂,通过阻止肿瘤细胞内表皮生长因子(EGFR)和HER2的同质和异质二聚体形成,抑制其自身的磷酸化,阻断下游信号通路的激活,从而抑制肿瘤细胞生长。
2018年,吡咯替尼凭借II期临床研究数据获NMPA附条件批准上市;2019年,吡咯替尼被纳入国家医保;2020年,吡咯替尼凭借两项重要III期研究(PHENIX、PHOEBE)结果获得完全批准上市,联合卡培他滨用于表皮生长因子受体2(HER2)阳性、接受过曲妥珠单抗的复发或转移性乳腺癌患者的治疗;2022年,吡咯替尼获批第2个适应症,与曲妥珠单抗和多西他赛联合,用于表皮生长因子受体2(HER2)阳性早期或局部晚期乳腺癌患者的新辅助治疗。
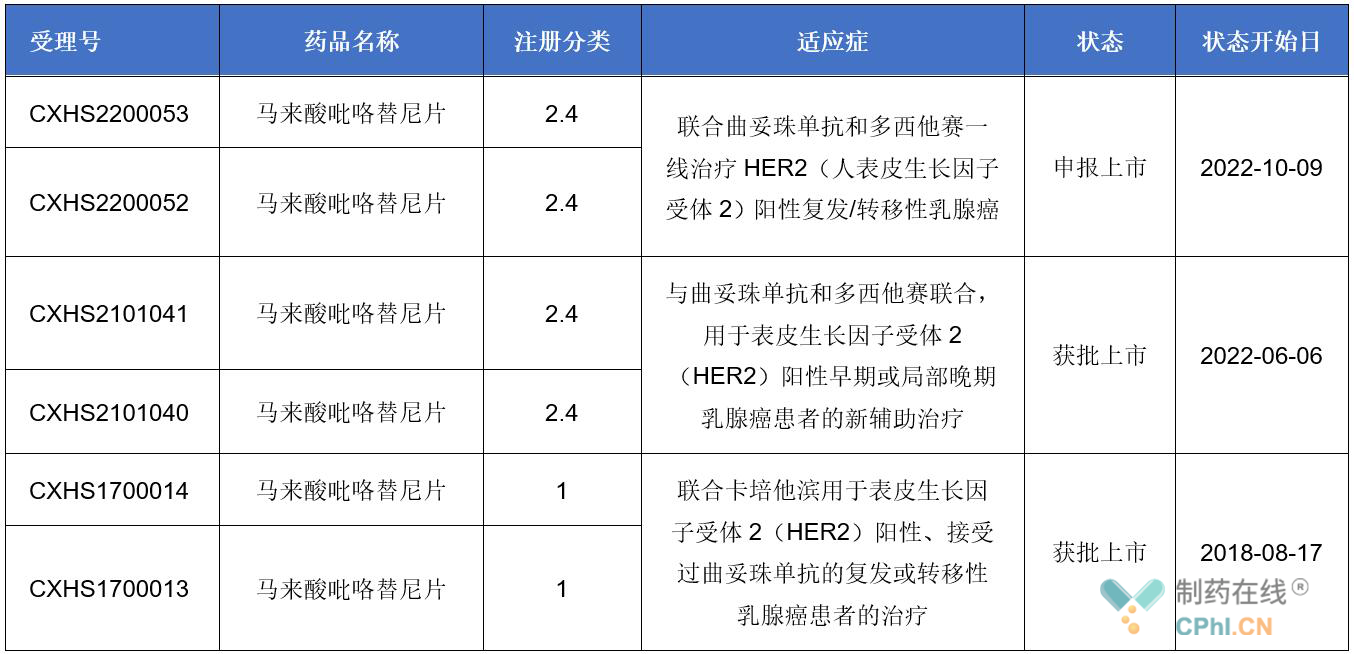
(资料来源:CDE官网)
此外,还在拓展针对胆道癌、胃癌等多个适应症。
乳腺癌市场潜力巨大
根据2020年世界卫生组织国际癌症研究机构(IARC)发布的数据,乳腺癌已成为全球第一大恶性肿瘤,是女性最常见的恶性肿瘤之一1。在我国,2020年中国癌症数据显示,乳腺癌发病率占全身各种恶性肿瘤发病率的9.1%(41.64万);乳腺癌患者死亡病例约11.72万例1。表皮生长因子受体2(HER2)阳性乳腺癌约占全部乳腺癌的20-25%。
目前,国内外已上市用于乳腺癌治疗的HER2小分子抑制剂有Lapatinib(商品名:Tykerb)、Neratinib(商品名:Nerlynx)和Tucatinib(商品名:Tukysa)。经查询EvaluatePharma数据库,2021年Lapatinib、Neratinib、Tucatinib全球销售额合计约为6.87亿美元。
参考文献:
1.IRAC官网数据:https://www.iarc.fr/faq/latest-global-cancer-data-2020。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57