走不完的偏差
12月26日,FDA公布一则药品召回通告,辉瑞子公司Hospira名下三种药品,4.2%碳酸氢钠注射液、8.4%碳酸氢钠注射液和硫酸 阿托品注射液,均因可能存在玻璃颗粒物同日发起召回。
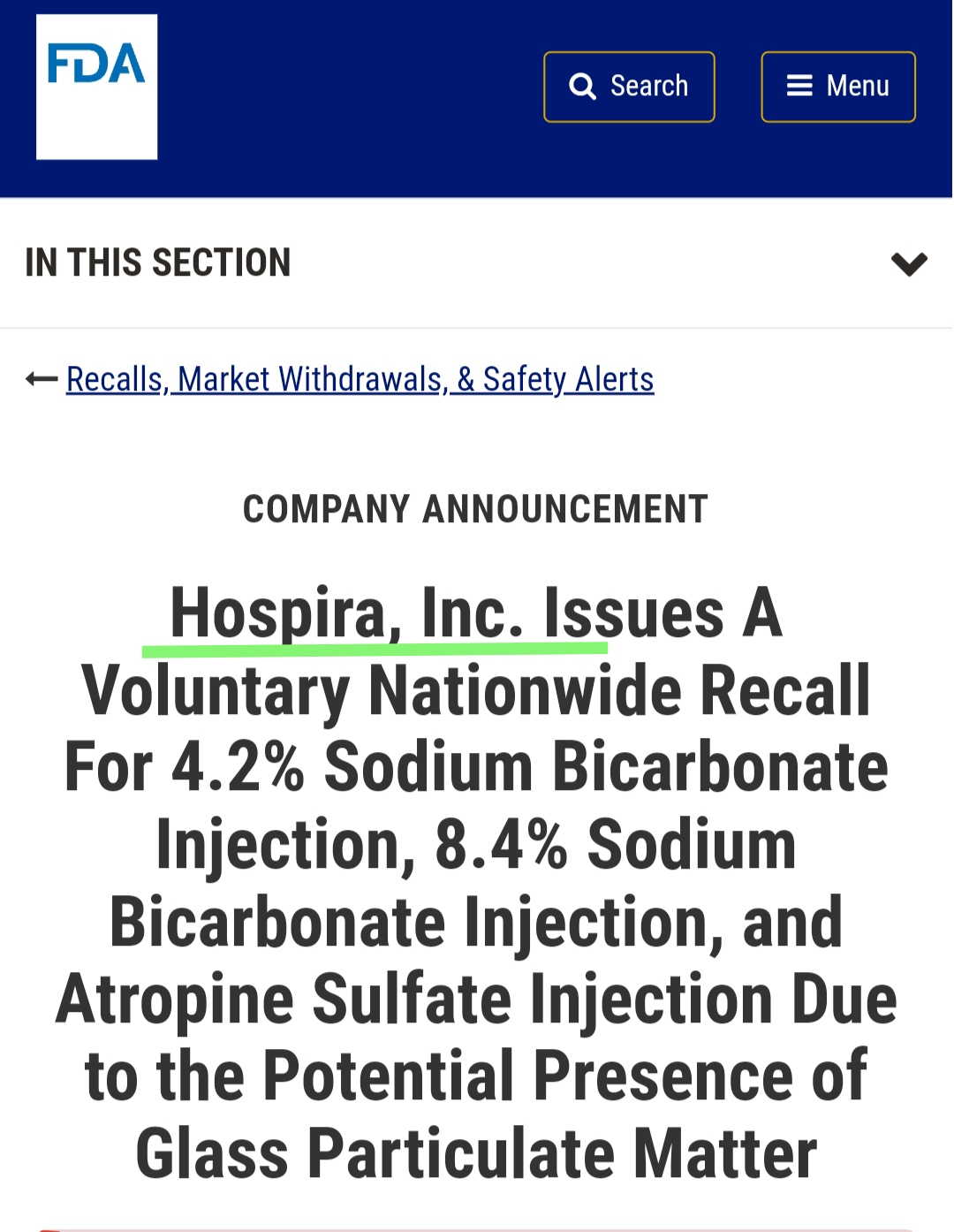
图源FDA
距离上一个因玻璃颗粒异物的注射用博来霉素药品召回,仅仅过了4天(点击查看本事件分析文章)。
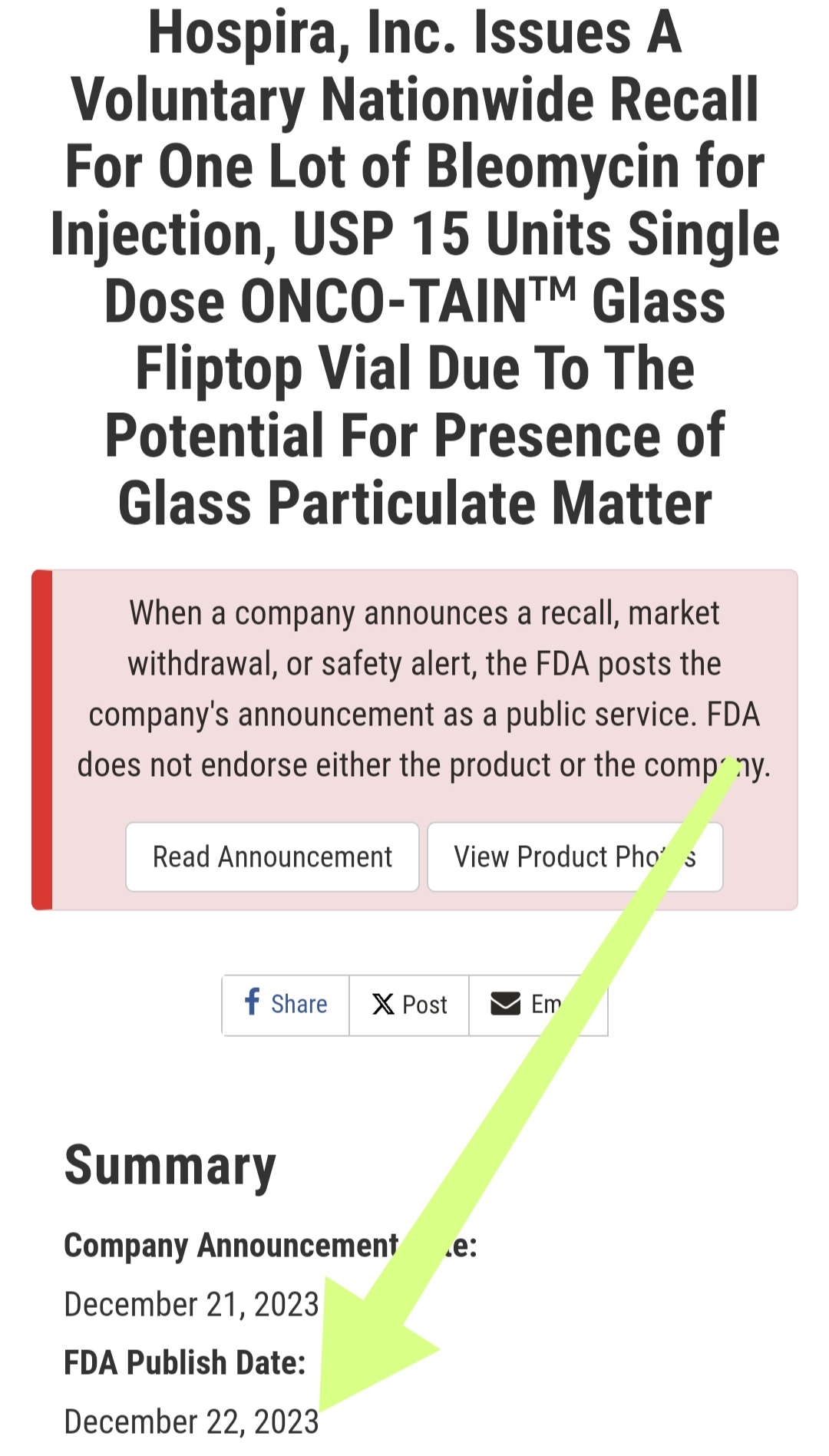
图源FDA
像这样一下子召回三种药的事,Hospira也不是第一次出现。在10月2日,1%盐酸利多卡因注射液和2%盐酸利多卡因注射液发起召回,同时召回的还有本次的4.2%碳酸氢钠注射液。(点击查看本事件分析文章)
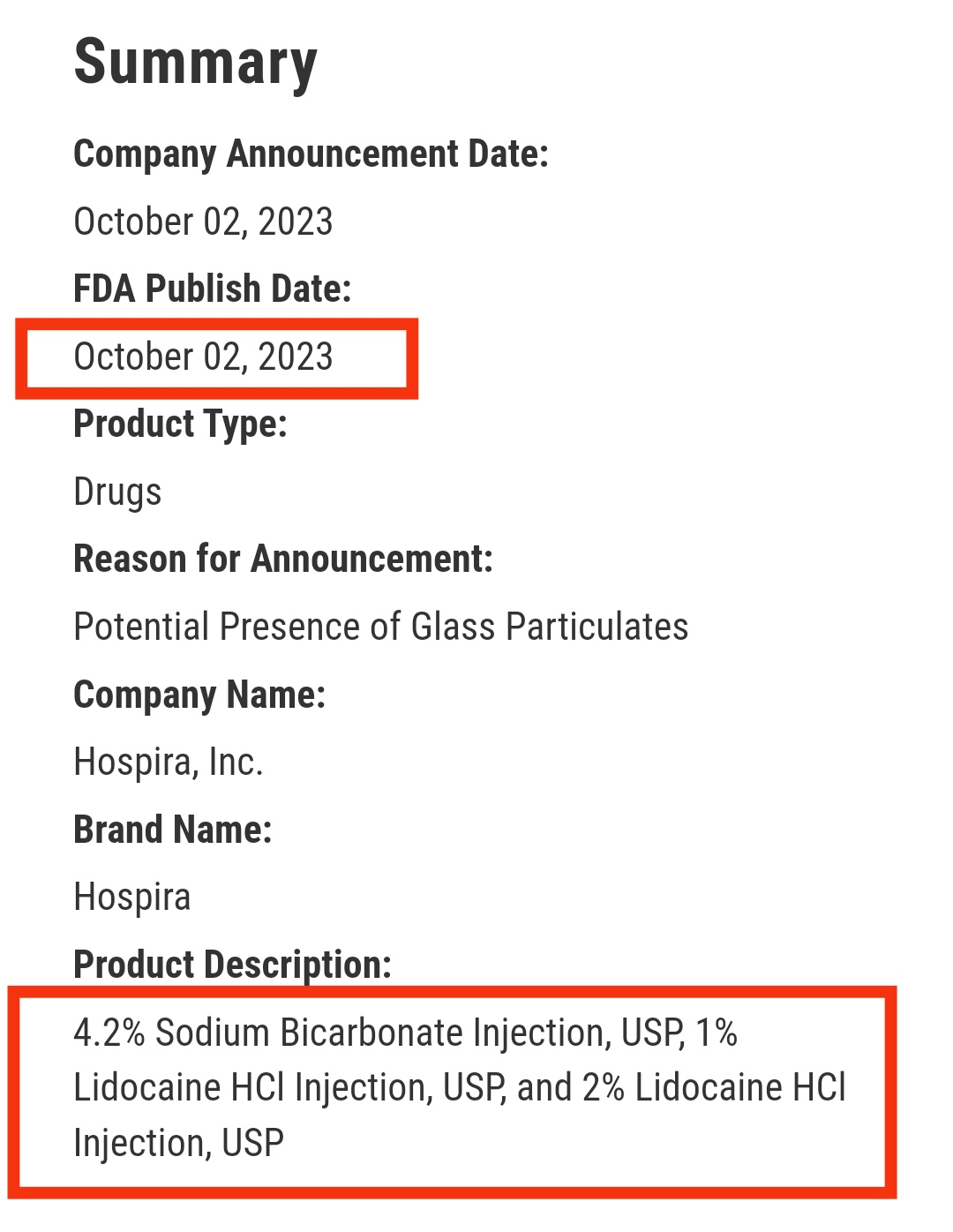
图源FDA
10月份召回的内包装方式同12月26号的一致,不排除是同一供应商生产提供。
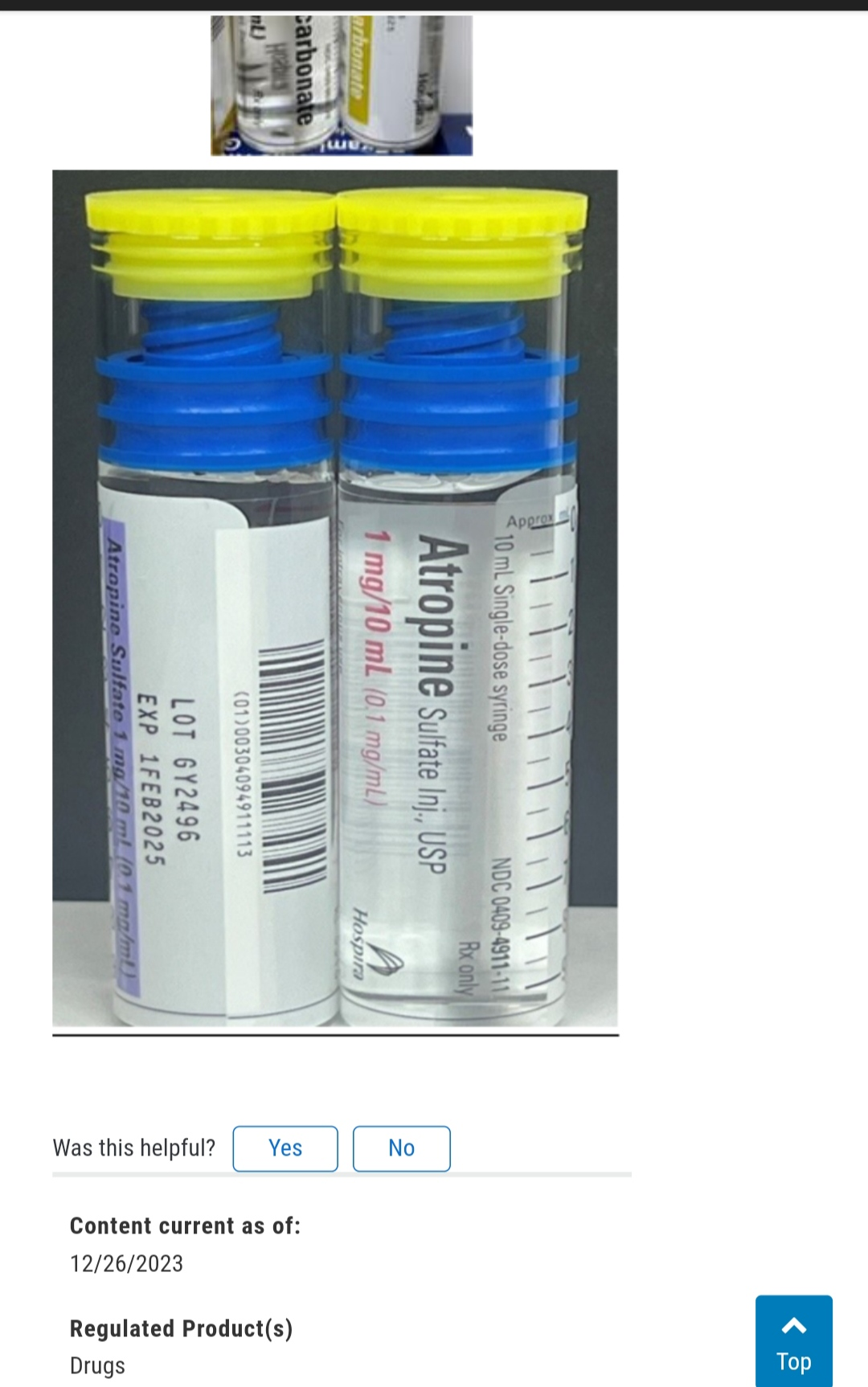
图源FDA
从10月到12月,已经有五个使用同一类型内包材的药品出现玻璃颗粒异物。如果内包材都指向同一生产企业,那么可能会有更多的药品会出现类似情况。而且我们从批号跨度也可以看出,如果是同一批次的内包材,那么这次的采购量已经能满足一年半左右的生产需求。这种集中采购,如果是仓库空间有限,或者费用有限,一般不会出现的。因为这个采购量太大,会挤占其他原辅料的空间,且相当于把资金提前支出掉,太过于浪费。
所以,我们预估的情况是,这些涉事药品所使用的内包材,大概率不是一个批次的产品。如果是内包材自身质量缺陷,那应该属于连续批次,所以才会重复重现同一个玻璃颗粒异物的问题。当然,这是在责任划分中的一个推测而已,并不是明确的一个指向。
此外,即使真是内包材质量原因导致玻璃颗粒异物,那Hospira作为药企,也是有责任的。因为药品生产型企业,是不能仅凭借原辅料的出厂检验报告就投料的。换句话说,你自己得有金刚钻,才能去接下这个瓷器活。哪怕你不知道具体的生产工艺,也要知道有哪些控制点。如果内包材瓶壁上有玻璃渣,然后在清洗阶段不一定能完全去除,这妥妥的不能流入生产环节。要知道在生产线,一旦原辅料流入,就属于沉没成本,往下走的越远,前期投入的就越多,离变现也就越近,你也越舍不得放弃。所以把不合格品卡在投料前,是最经济、最科学、最 理想的状态。
当然也可能是生产阶段,比如灌装时产生的玻璃渣,具体原因可能是什么,我们在之前的文章里也提到过。在这我们引入一个其他领域的操作,在打印机卡纸后,可能会出现取出时纸张破碎,哪怕你看到里面没有卡着纸屑,也不行,要把取出来的纸张拼凑一下,看是不是一张完整的纸。在外科手术后拆线时,也是会把线合在一起,看下有无线头断在肌肉内。这两个领域有个特点就是已知完整的是怎么样的状态,所以直接目测就好。
再讨论一个理想的关于灌装过程压碎瓶子后的清场处理,最期待的是每个瓶子都是同一重量,一点差异都没有。然后在清理碎屑时,把碎屑放在一起称量,明确是不是已经收集到所有的碎屑。但这是个奢望,一方面不同模具下的瓶子会有重量差异,再就是动辄上万的规模下,无法明确碎瓶原本是几号模具的产品,要拼起来看瓶子完整度,更加不现实。所以,碎屑遗漏会是一个无解的题,只能尽量避免,无法杜绝。除非以后有类似拍照3D建模的方式,把碎屑摆在一起,一个照片拍完,就系统自动形成瓶身结构图,一眼看出来少了哪块玻璃。
而且理论上出现过这么多批次、这么多品种的同一质量问题后,企业该生产线应该暂停生产,彻底的去分析一下原因。一个个排除,实在排除不掉的,可能就是真正的原因。比如对于仓库内的内包材进行复检,看下是否有不合格项目。以及统计历史数据,看之前的和现在的有无区别。
但目前看,可能没有这样做,当然也可能已经在做,且做得更好,只不过外界没有渠道去了解。毕竟一个药企生产线的暂停生产,往往引发一系列的影响,还要有资源做支撑,哪有那么多理想化的模式可实施。
本文均为个人观点,旨在抛砖引玉,欢迎各位同道前辈拍砖指正。具体情况,以官方调查为准。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57