胰腺癌,被誉为"万癌之王",因其高侵袭性、高致死率和低治愈率而备受医学界关注。2024年3 月 25 日,凡恩世(Phanes Therapeutics)宣布,美国 FDA 授予其 PT886 快速通道资格,用于治疗转移性 Claudin 18.2 阳性胰腺癌患者。此前,PT886 已于 2022 年获得了 FDA 授予用于治疗胰腺癌的孤儿药资格,并于今年 2 月在中国获批开展临床试验。PT886是一种创新的双特异性抗体,利用双平台技术专门设计用于针对claudin 18.2和CD47。这一药物独特的工作原理是通过抗体依赖性细胞毒性和吞噬作用来消除肿瘤细胞。根据临床前期数据,PT886在体外和体内都显示出了显著的活性。
目前,PT886的安全性、耐受性、药代动力学、药效学以及初步治疗效果正在首次人体1/2期TWINPEAK研究(NCT05482893)中进行全面评估。此外,一个多中心、开放标签的1期临床试验,旨在进一步评估PT886的疗效,也预计在今年4月份顺利完成。这些研究为PT886的临床应用提供了重要的证据。
一 胰腺癌治疗现状
在全球范围内,胰腺导管腺癌(Pancreatic ductal adenocarcinoma,简称PDAC)是导致癌症相关死亡的主要原因。许多患者在被诊断时,病情已发展到不可切除或转移性阶段。尽管医学技术不断进步,PDAC的生存率却仍然处于较低水平。目前,只有手术有能力实现根治性治疗,当无法进行根治性切除时,患者的5年生存率不到5%。
对于不可切除或转移性PDAC患者,联合化疗是主要的治疗手段。近年来,联合治疗方案的发展,如吉西他滨与白蛋白结合紫杉醇(nab-paclitaxel)以及FOLFIRINOX(包括奥沙利铂、伊立替康、亚叶酸和氟尿嘧啶的联合治疗)等,为转移性PDAC患者带来了更好的生存前景。然而,需要注意的是,某些靶向药物仅适用于具有特定基因改变的患者群体。因此,研究新的靶向药迫在眉睫。
二 双特异性抗体PT886瞄准靶点CLDN18.2及CD47
靶向CLDN18.2/CD47的新型双特异性抗体PT886研究应运而生。CLDN18.2和CD47,这两种分子在胰腺癌发病过程中扮演着关键角色。CLDN18.2是一种紧密连接蛋白,与胰腺癌细胞的生长、转移等过程紧密相关;而CD47则是"不要吃我"的信号分子,帮助癌细胞逃脱免疫系统的攻击。通过同时针对这两个靶点,新型双特异性抗体有望更有效地阻断胰腺癌细胞的生长与转移,并激活免疫系统对癌细胞的清除作用。
研究团队在实验室条件下对所研发的新型双特异性抗体进行了大量验证。结果表明,该抗体能够特异性地识别并结合CLDN18.2和CD47分子,有效抑制胰腺癌细胞的生长和迁移,同时促进免疫细胞对癌细胞的杀伤作用。这些发现为胰腺癌的治疗提供了新的思路和手段。
三 2022年:PT886获批孤儿药资格
2022年6月,美国食品与药物管理局(FDA)为PT886赋予了孤儿药身份,旨在针对胰腺癌患者进行治疗。就在今年的1月,PT886已经成功地向FDA提交了新药研究申请(IND)。同样值得一提的是,这家公司的另一款产品PT217,也获得了FDA的孤儿药资格,用于治疗小细胞肺癌。其另一款药物PT199也成功获得了IND的批准。PT886的孤儿药身份及最近的IND批准都是在同一个月内实现的,显示出研究团队正迅速推进其临床试验的进程。
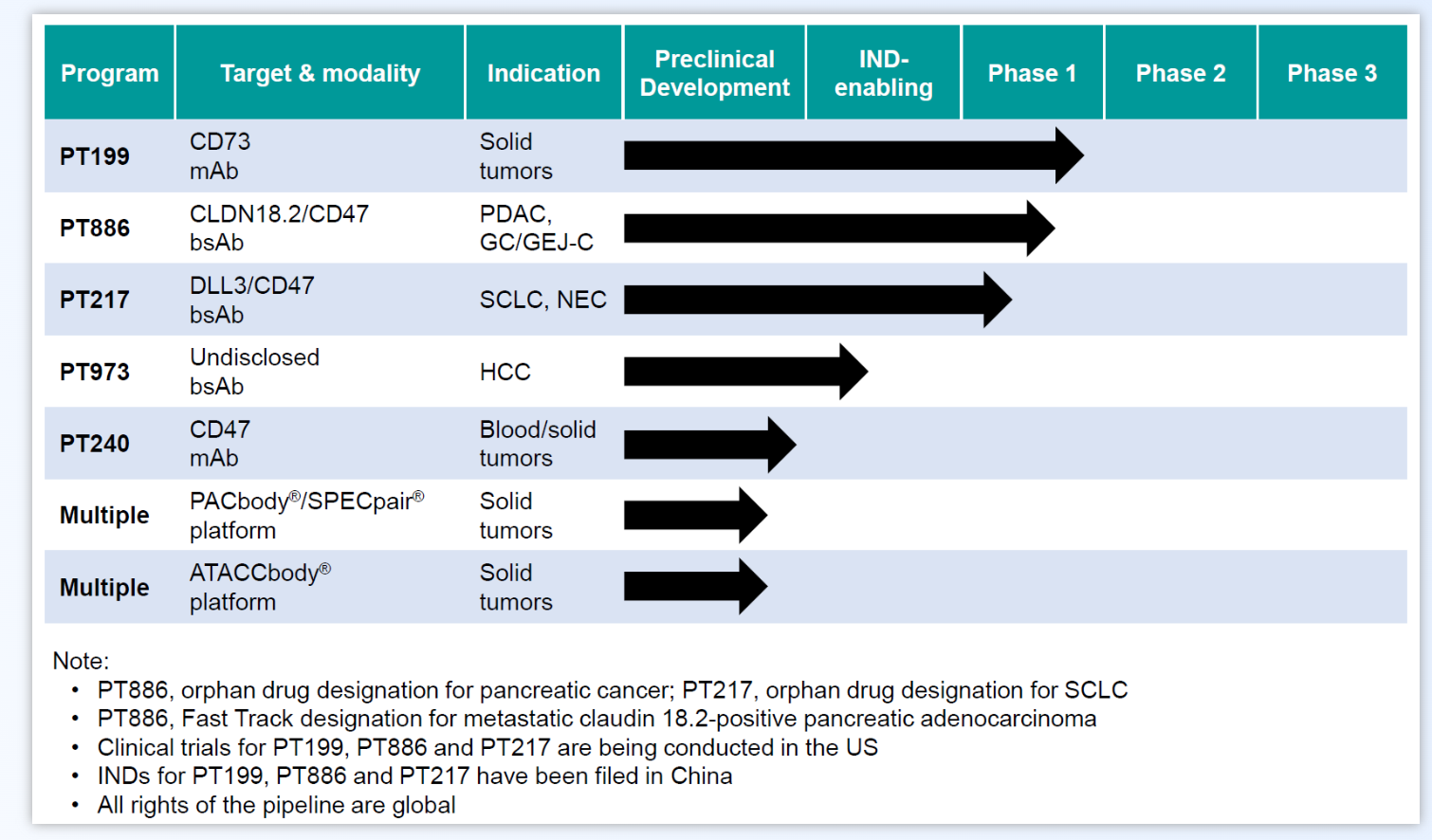
来源:公司官网www.phanesthera.com
在2022年美国癌症研究协会的年度会议上,公布的相关研究成果表明,PT886能与细胞表面的CLDN18.2进行高亲和力的单价结合,同时与CD47.3也有低亲和力的单价结合。这种特性让PT886能够优先识别并结合那些过表达CLDN18.2和CD47的肿瘤细胞,从而降低了与仅表达CD47的正常细胞的结合机会。
值得注意的是,PT886在针对表达CLDN18.2的肿瘤细胞时表现出较强的活性,而对不表达CLDN18.2的正常细胞的活性则微乎其微。这一特性在吞噬实验中也得到了验证,当与CLDN18.2结合时,PT886能更有效地刺激细胞的吞噬作用。
除了与CLDN18.2和CD47的靶向作用外,PT886还拥有全功能的Fc区域,这使其能够直接调动自然杀伤细胞(NK细胞)和巨噬细胞的活性,从而实现对肿瘤细胞的杀伤。PT886所展现出的强大抗肿瘤活性在体内的胰腺癌异种移植模型中也得到了验证。在此模型中,仅仅使用低至1mg/kg的PT886剂量便可以彻底清除肿瘤。此外,在非人灵长类动物(NHP)的研究中,PT886也表现出了很好的安全性。
四 2023年,PT886给药首例胃癌/GEJ/胰腺癌患者
2023年3月,第一个病人在I期临床研究中(编号为NCT05482893)接受了PT886,这款创新药物,其主要应用于治疗胃、胃食管交界处以及胰腺的腺癌。研究小组也寄望于它能激活T细胞,通过识别肿瘤新抗原,间接摧毁claudin 18.2低表达或阴性的肿瘤细胞,进一步激发适应性免疫反应。此外,PT886的抗CD47部分经过高度分化,其与人红细胞的结合性尽可能低,以确保其与肿瘤细胞上的CD47保持强烈的结合活性。
这项多中心、开放标签的1期临床试验正致力于对PT886的安全性、耐受性、药代动力学、药效学及初步疗效进行全面评估。参与的患者需经组织学或细胞学诊断为局部晚期或转移性胃癌、胃食管交界处癌和胰腺癌,并且在所有标准治疗无效、不耐受或不适宜之后本研究采用标准的3+3剂量递增设计方案,PT886单药治疗的起始剂量设定为每周0.1 mg/kg。其它考量的临时剂量水平为:每周0.3 mg/kg、每周1mg /kg、每周3mg /kg和每周6mg /kg。在试验的剂量扩展部分,将评估两个剂量,可能包括最大耐受剂量(MTD)和一个较低剂量,或两个较低剂量,这些都将从升级阶段得出。该试验的主要目标在于确定PT886的剂量限制性毒性、MTD以及为2期推荐的剂量。除此之外,通过客观有效率来评估其初步疗效,该研究预计在2024年4月结束。
五 2024年:快速通道资格认定
PT886是一种针对claudin 18.2的精准疗法,该分子在肿瘤中具有关键作用。PT886凭借其独特的抗CD47设计,显著提升了其抗肿瘤活性并扩大了治疗适用范围。经过充分的研究验证,该药物在2024年3月获得了快速通道审批,有望成为转移性claudin 18.2阳性胰腺腺癌患者的新治疗选择。目前,PT886的安全性、耐受性、药代动力学、药效学以及初步疗效正在进行的TWINPEAK 1/2期临床研究(NCT05482893)中接受全面评估。这是一项开放式的剂量递增与扩展研究,现正招募至少18岁的患者参与。符合条件的患者需患有不可切除的晚期或转移性实体胃、胃食管交界处(GEJ)或胰腺肿瘤,且曾接受过针对晚期疾病或治疗不可及、无法耐受的疾病治疗。
该研究的重点在于明确药物的剂量限制性毒性、最大耐受剂量以及PT886在2期临床试验中的推荐剂量。此外,研究还将评估药物的药代动力学、免疫原性以及初步疗效。同时,研究人员也将关注与主要疗效终点相关的药效学标志物和预处理claudin 18.2的表达情况。预计该试验将招募约114名患者,并计划于2025年12月前完成主要研究目标。
六 结语
凡恩世创始人兼首席执行官王明晗博士表示:"PT886有可能成为转移性Claudin 18.2阳性胰腺癌患者的变革性治疗选择,而该疾病当前的标准疗法获益有限。PT886是凡恩世在创新治疗方法和实用技术匠心设计方面的巧妙创新的产物。"
参考文献
[1] 凡恩世PT886获得FDA快速通道资格认定,用于治疗转移性claudin 18.2阳性胰腺癌患者. Retrieved Mar 25 , 2024, from https://mp.weixin.qq.com/s/3YQfr-lnnJRksLbBdS6lLA
[2] 凡恩世制药claudin 18.2/CD47双抗PT886临床试验申请获CDE受理. Retrieved Dec 11, 2023, from https://mp.weixin.qq.com/s/WVQe3sRqWtICBvyGt62cOA
[3]Overman MJ, Melhem R, Blum-Murphy MA, et al. A phase I, first-in-human, open-label, dose escalation and expansion study of PT886 in adult patients with advanced gastric, gastroesophageal junction, and pancreatic adenocarcinomas. J Clin Oncol. 2023;41(suppl 4):TPS765. doi:10.1200/JCO.2023.41.4_suppl.TPS765
[4] 公司官网www.phanesthera.com



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57