召回,旷日持久。
2022年3月18日,据fiercepharma报道,葛兰素史克完成了一款**的召回工作。
究其原因,有客户向企业反映**有问题,而企业研究过实物后认定客户反映的两个瓶子均有裂缝。继而推测问题出现在制造过程中,于是在2021年2月份对该Shingrix **发起召回。但没有想到的是,整个召回过程持续了一年多,总共召回了超十三万支。

这款**产品是针对带状疱疹的,而裂缝不是简单的剂量确实问题,还会带来无菌性风险。外界空气中的微生物会经由裂缝进入**,一旦误用,会有一定的概率感染败血症、侵袭性全身感染等,哪怕没有活的微生物进入瓶中,也有可能引入内毒素等物质,引起发热等症状。
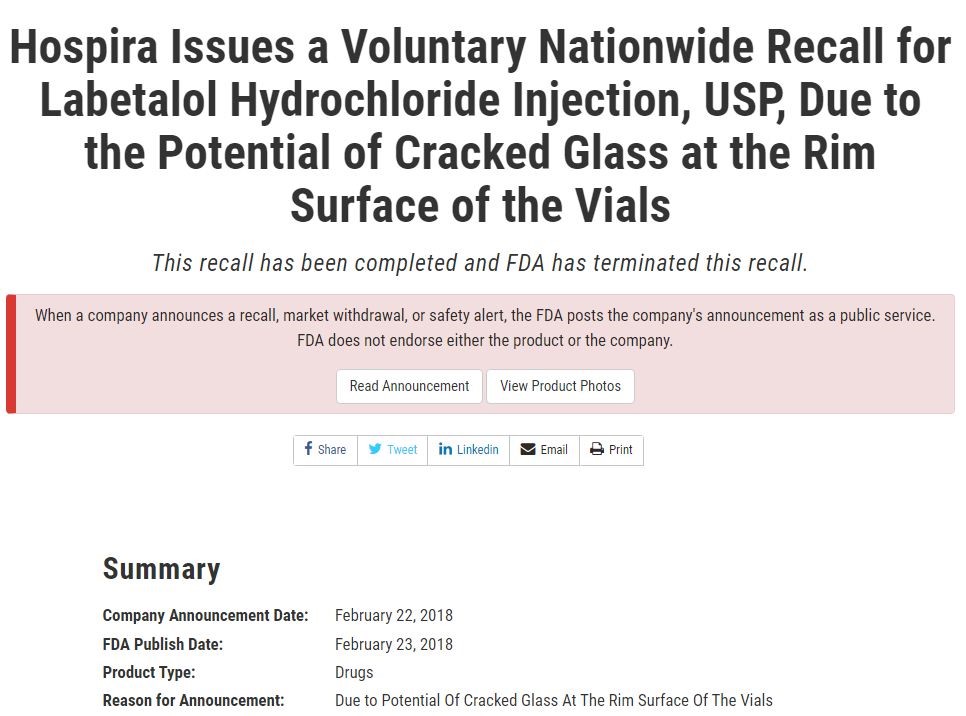
玻璃瓶的裂缝在制药界并非常态,但也绝非个例,2018年2月,辉瑞制药自愿内召回4个批次盐酸拉贝洛尔注射液,原因就是小瓶边缘表面可能出现玻璃破裂。
对于类似的事件,抛开试剂与内包材不匹配的原因外,更多的责任可能在瓶子本身。业内人士对于此类事件的关注点,也更多的限定在"涉事批次用的是哪家的玻璃瓶?什么材质?"
毕竟我们制药人"见不贤而内自省也"属于常规操作,而FDA对于类似情况也更多的以风险评估作为处理方向。对于瓶子的裂缝可能是本身就带有裂缝,这样的话可以用设备或者人为检测挑选的方式来杜绝进入下游使用,但理论上可行并不意味着实际生产中好用。要知道注射剂的灌装,单一批次也动辄几千上万支,这种人为挑选合格瓶子的方式,从人工和时间成本上就很难操作。这些时间成本最终会上升到药品价格上,这对于市场竞争力而言是负面效应。
而一旦裂缝发生在灌装,比如轧盖过程中,那么裂缝部位如果只是发生在铝盖覆盖处,可能会被铝盖挡住,肉眼无法察觉。也就是一旦灌装后,即使有裂缝,那也非常难以检出。继而把风险转移到使用过程中,这种难以发现的风险往往会带来很多调查取证中的困难。
所以召回的重要性无论从调查原因,还是杜绝使用中的风险,都是显而易见的。但这召回时长,着实是让人焦虑的。毕竟**更多是在医疗机构使用,而非直接出售给个人。 从生产企业到终端客户群体,理论上是非常通顺的沟通发布渠道。却也用了这么久才完成,可见如果是OTC药物,那么从消费者个人手中召回,则更加难上加难。这说明召回渠道并非我们认为的那样畅通无阻,召回信息在往下游的传递过程中,必定是有停滞不前,越往下游越无法及时获知药品的召回。
如果遇到节假日等特殊情况,很可能导致在召回发生后,下游依然在使用有问题的药品。而企业作为药品召回的主动方,掌握这药品的流通下游。监管方则往往限定在生产企业的驻地,对于企业提供的数据等把控真实性,是有难度的。可能会存在召回不彻底、末端有残留的状态。而使用单位则被动的等待上游的通知,很难去主动要求召回,这对于召回也是一种难度。
而电子监管码的问世,可能从源头增加了流通方向的监控,只要一盒一码,那么理论上是可以解决这个问题的。当然,作为制药企业,也要定期开展召回的模拟操作,及时发现实际实施时存在的短板,做到有的放矢。试想一下,如果一些事关生命的药品召回,不断的拖延停滞,那么无论对于企业还是患者,才都是灭顶之灾。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57