7月6日,卫材和渤健宣布,FDA已接受阿尔茨海默病(AD)药物lecanemab的上市申请并授予其优先审评资格,PDUFA日期为2023年1月6日。
Lecanemab是卫材和BioArctic合作研发的成果,由卫材和渤健共同负责该产品用于AD治疗的开发和商业化。Lecanemab是一种用于治疗AD的人源化单克隆抗体,可选择性结合、中和、消除可溶、有毒的Aβ聚集体(原纤维),这些聚集体被认为加速AD的神经退行性变进程。因此,lecanemab可能对疾病病理学产生影响,并减缓疾病的进展。目前,lecanemab正被开发作为唯一一种无需滴定即可用于治疗早期AD的抗Aβ抗体。
Lecanemab的BLA(生物制品许可申请)申请基于一项IIb期临床试验结果,研究共纳入856例早期AD患者,这些患者存在轻度认知障碍 (MCI)并经证实存在淀粉样蛋白病变。
Lecanemab的BLA提交是基于概念验证 IIb期临床研究(Study-201)的临床、生物标志物和安全性数据以及验证性III期临床 Clarity AD 研究的安全性数据。Study-201 研究探索了 Lecanemab 治疗对降低 Aβ 和认知下降的影响。
在治疗18个月时,每两周一次10mg/kg Lecanemab使脑Aβ蛋白减少0.306 SUVr 单位(基线平均值为 1.37),并且超过 80% 的受试者视觉读数变为淀粉样蛋白阴性。此外,淀粉样蛋白减少的程度与 ADCOMS(阿尔茨海默病综合评分)、CDR-SB(临床痴呆症评级-总和)和 ADAS-cog(阿尔茨海默病评估量表-认知分量表)的临床下降较慢相关。
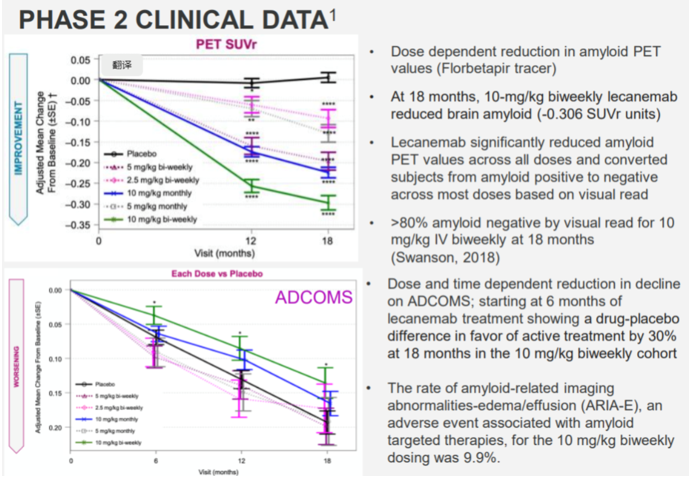
Study-201研究结果(图片来源:参考1)
安全性方面,Lecanemab组患者的淀粉样蛋白相关影像学异常水肿/积液(ARIA-E)的总体发生率是 9.9%(16/161),而安慰剂患者为 0.8%(2/245)。
目前,Lecanemab在1795名患者中的III期确证性临床试验Clarity AD 研究正在进行中,并将于今年秋季披露数据。FDA 已同意 Clarity AD 研究在完成后作为验证性临床以支持Lecanemab的完全批准。
Lecanemab能否为渤健带来转机?
2021年6月,渤健和卫材共同研发的Aduhelm获FDA批准,成为近20年来美国第一个获批的阿尔茨海默病治疗药物。但Aduhelm一直命运多舛。经历最初的关键研究失败,到FDA力挺,再到美国医生停止开出Aduhelm处方,加上医保覆盖限制,渤健不得已几乎完全放弃了该药的营销计划。
据渤健2022年第一季度财报,Aduhelm第一季度销售额仅为280万美元。而此前,知名金融机构路孚特的十余位分析师曾联合预测:Aduhelm在上市后销售额一个季度可能会突破1079万美元。
受此影响,渤健于今年5月份裁减了销售团队,在调整公司架构的同时,渤健的首席执行官Michel Vounatsos也宣布了离职。
目前,渤健已将重点转移到其第二个抗淀粉样β抗体Lecanemab上。而 Lecanemab 能否接过接力棒,重获商业成功?还要看其后续临床试验结果。
新药研发失败率高达99.6%,阿尔茨海默病缘何成为研发黑洞?
据美国药品研究与制造商协会在2018年的报告显示,阿尔茨海默病新药研发的失败率高达99.6%,如今这一比例或将再次提升。
就在前两日,Alector刚向美国证券交易委员会提交的一份文件中披露,艾伯维决定终止一项专注于开发阿尔茨海默病治疗药物AL003的合作。目前Alector已从其管道中移除AL003。
阿尔茨海默病之所以成为药企研发黑洞,主要是因为医学界对其发病机理知之甚少,大多数医疗手段都是通过观测病人的特征来判断发病原因。以Aduhelm为代表的"Aβ级联假说"正是AD最典型的病例特征,同时也是最主流的病理假说。
Aβ级联假说的主要内容是,在正常人的大脑中,存在一种大蛋白淀粉样前体蛋白(APP),它被专门的酶所切割成β-淀粉样蛋白和其他短链淀粉样蛋白,不会有任何的影响。但随着时间推移,人脑中对于APP的处理效率下降,从而逐渐形成积累,也就形成了斑块。很多AD患者出现基因突变,导致APP被切割后的β-淀粉样蛋白变得更粘稠或更丰富,而他们也更容易患上AD。这就是"Aβ级联假说"。
其实现实中,AD患者除出现淀粉斑块外,还会出现Tau蛋白异常、铁元素超负荷、血管结构改变、胰岛素含量过高等现象,并由此诞生了Tau 蛋白假说、铁离子紊乱假说、神经炎症假说等路线。
或许在未来几年中,就会出现其他路线的AD新药,如"Tau蛋白假说"等。但即使如此,"Aβ级联假说"也是目前为止距离成功最近、最主流的研发路线。
阿尔茨海默病作为最大的神经退行性疾病,一直备受医药界的关注,无数大小药企前赴后继,从各种机制、靶点入手,开发候选药物,但受限于基础研究的发展,目前所有的产品都只能基于"假说"层面进行探索。
尽管极高的失败率使阿尔茨海默病领域成为药企的"研发黑洞",但极大的市场潜力仍另企业前赴后继,通过不同机制试图突围,企业的不断投入和基础研究的不断进步,最终必将会诞生一款真正使患者受益的突破性药物。
主要参考资料:
1. THE U.S. FDA ACCEPTS AND GRANTS PRIORITY REVIEW FOR EISAI'S BIOLOGICS LICENSE APPLICATION OF LECANEMAB FOR EARLY ALZHEIMER'S DISEASE UNDER THE ACCELERATED APPROVAL PATHWAY
2. Mintun et al., (2021). Donanemab in Early Alzheimer's Disease. NEJM, DOI: 10.1056/NEJMoa2100708
3. Biogen terminates an Aduhelm study no thanks to restricted Medicare coverage;Fierce Pharma
4. Eisai and Biogen Gun for Speedy Approval for Another Alzheimer's Drug



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57