在去年的ESMO大会上,一款崭露头角的新型药物Tarlatamab对小细胞肺癌这一长久以来难以有效治疗的癌症类型带来了革命性的突破,标志着该领域首次有了特效药的问世。Tarlatamab作为一种双特异性抗体的BiTE类药物,其独特机制在于能够同时锁定癌细胞和T细胞,进而引导并激活T细胞对肿瘤实施精准打击。
如今,与Tarlatamab原理相似的另一款BiTE药物M701引发了业界的广泛关注。这款新兴的治疗方案将焦点对准了多种癌症中极为棘手的一种并发症--恶性腹水,其潜在的疗效为战胜这一难题提供了新的希望。
恶性腹水,即MA,通常源于恶性肿瘤在局部的浸润或转移所导致的腹腔液体累积。这种现象在诸如卵巢癌、胃癌、结直肠癌等腹腔和盆腔的实体肿瘤晚期中尤为常见。当其出现时,往往意味着肿瘤已进入晚期阶段,成为预后不良的显著征兆。晚期病人常常因为并发恶性腹水而经历恶心、呕吐、腹胀、食欲减退、全身乏力等一系列不适的症状。这些症状极大地降低了患者的生活质量和预期寿命,通常这类患者的自然病程不会超过半年。
在临床实践中,医生们通常采用利尿、腹膜静脉分流、腹腔穿刺引流并局部药物灌注以及针对原发疾病的治疗等方式来缓解恶性腹水,尽管这些方法可以在一定程度上起到暂时缓解的作用,但其长远效果并不理想。恶性腹水常常会反复发作,并可能引发其他严重的并发症。尤其是穿刺引流过程,由于操作涉及体内外环境的交互,因此容易引发感染问题。
2009年4月,欧洲药品管理局 (EMA) 批准卡妥索单抗用于腹腔注射治疗恶性腹水,也是在欧洲首个获批治疗 EpCAM 阳性的恶性腹水药物,该款抗体能同时针对多数上皮癌高表达的粘附分子EpCAM和T细胞标志物CD3,从而显著延长了恶性腹水患者的中位无穿刺生存期,从原先的11天提升至46天[2]。然而,囿于当时的技术水平,卡妥索单抗的结构基于鼠源抗体,这带有引发过敏反应的风险,并间接影响了其在治疗上的效果。统计数据表明,超过94%的患者在接受四次卡妥索单抗注射后,体内出现了抗药抗体。
随着科技的不断进步,研究者们成功研制出了一种人源化双特异性抗体M701,这一抗体同样能精准靶向EpCAM和CD3分子。值得一提的是,M701不仅继承和发扬了卡妥索单抗的优势,而且作为国内首个将免疫疗法与靶向疗法相结合的多重机制癌性腹水治疗药物,其诞生无疑为恶性腹水治疗领域带来了全新的希望。
一、M701
M701是一款专为注射使用的重组双重特异性抗体,专门针对肿瘤细胞上的EpCAM靶点以及免疫细胞上的CD3靶点。一旦M701注入体内,它能够同时锁定住免疫细胞和肿瘤细胞。其中,CD3抗体发挥着桥梁作用,连接并激活T细胞,从而使其对EpCAM呈阳性的肿瘤细胞进行有效的杀伤作用[4]。
上皮细胞黏附分子(EpCAM)是黏附分子家族的重要成员,属于跨膜糖蛋白。众多研究揭示,EpCAM在诸多类型的肿瘤组织中展现出显著的高水平表达,涵盖了头颈部肿瘤、结肠癌、胰腺癌、食管癌、胃癌、乳腺癌、卵巢癌及前列腺癌等。更重要的是,EpCAM的过高表达与肿瘤细胞的侵袭性转移及不良预后存在紧密关联[5]。
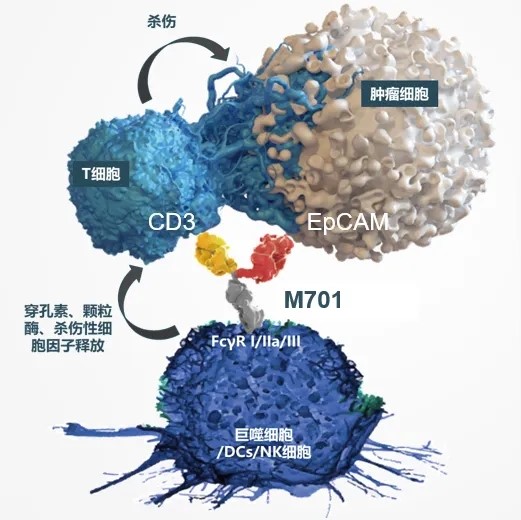
M701作用机制(图片来自武汉友芝友生物制药有限公司官网)
二、M701临床研究疗效
在2021欧洲肿瘤内科学会(ESMO)年会上,武汉友芝友生物报告了M701在标准治疗失败的恶性腹水患者中的I期试验的中期结果。

截止到2021年2月,共有23名患者被纳入本研究,包括12例卵巢癌患者,5例胃癌患者和6例其他类型癌症患者。在能够进行有效评估的16例患者中,我们观察到腹水的客观缓解率(ORR)高达62.5%,即有10例患者呈现出明显的症状改善。更令人欣慰的是,所有评估患者的疾病控制率(DCR)达到了100%,表明所有接受治疗的患者病情均得到有效控制。其中,有3例患者实现了完全缓解(CR),7例患者获得了部分缓解(PR),而剩下的6例则病情保持稳定(SD)。中位总生存期(OS)为152天,显示出治疗对延长患者生存期的积极效果。进一步分析发现,卵巢癌患者和胃癌患者的中位OS分别为148天和209天,显示了治疗在不同类型癌症中的有效性。
值得注意的是,在病情得到部分缓解(PR)和完全缓解(CR)的患者中,EPCAM+/CD45+细胞比率持续降低这一发现表明,T细胞的持续募集和肿瘤细胞的消除可能是治疗取得成功的重要原因之一[6]。这项研究结果为我们深入了解癌症治疗的机制提供了新的视角,并为未来优化治疗方案提供了宝贵的参考。
三、恶性腹水临床研究项目
根据国家药品监督管理局药品审评中心(CDE)官方信息的最新披露,2024年3月4日,一款由武汉友芝友生物制药有限公司所研发的创新药物--注射用重组抗EpCAM和CD3人鼠嵌合双特异性抗体(M701)已顺利开启其Ⅲ期临床研究阶段。此阶段正致力于寻找适合入组的晚期上皮性恶性实体瘤患者,其中包括卵巢癌、胃癌以及结直肠癌等,特别是那些伴有恶性腹水的患者。此项研究标志着该药物在治疗恶性肿瘤领域又迈出了重要一步。
参考文献:
1.李先敏.腹腔热灌注化疗联合系统化疗治疗恶性腹水的疗效和安全性[J].中国临床医学 2023年12月第30卷第6期:975-980.
2.白杰.腹腔药物灌注治疗恶性腹水研究进展[J].医学综述 2021 年 5 月第 27 卷第 9 期:1740-1746.
3.陈 敏.双特异性抗体的免疫原性[J].中国临床药理学与治疗学 2021 Oct; 26( 10):1208-1212.
4.武汉友芝友生物制药有限公司官网.
5.司琳琳.EpCAM 作为肿瘤诊断标志物的研究进展[J].河南医学研究 2016 年 5 月第 25 卷第 5 期:846-848.
6.J. Xu.539P - Interim results of a phase I study of M701, a recombinant anti-EpCAM and anti-CD3 bispecific antibody in EpCAM-positive cancer patients with malignant ascites[J].ESMO Congress 2021.
7.国家药品监督管理局药品审评中心(CDE)官网.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57