
2019年5月8日,中国医药包装协会官网发布《药包材生产质量管理指南》(T/CNPPA 3005-2019),自发布之日2019年5月8日起实施,此指南被业界人手称为新的药包材GMP,本指南基于ISO15378的要求,采用GMP的语言描述相关条款,使包材企业和制药企业均能充分理解本指南的要求,并能正确的实施,本文为大家梳理了药包材GMP管理的痛点、难点和GMP实施关键点,可供药包材生产企业的内部或外部认证以及客户的合同目的,也可供制药企业执行药包材供应商审计参考使用。
一、我国药包材监督管理痛点
2012年4 月15日,央视《每周质量报告》曝光了一起与药包材相关的药害事件-"铬超标胶囊"事件,使得药用包材的安全性越来越受到各政府、媒体、监管部门和群众的关注,更是给药包材行业的产品质量安全敲响了警钟。
二、我国药包材监督管理难点
药品包装用材料、容器(以下简称"药包材"),尤其是与药品直接接触的包装系统(含功能性次级包材)、组件、给药装置和印字包材,是药品不可缺少的组成部分,它伴随着药品的生产、流通和使用全过程,因此药包材对于保证药品的安全性、有效性起着重要的作用,对药包材生产企业的审查和监管就显得尤为重要,我国药包材监督管理是一个从无到有、不断完善、循序渐进的过程,概括起来主要经历了四个阶段("缺少明确管理制度"阶段→"许可证制度"阶段→"注册证制度"阶段→"关联审评审批制度"阶段),各阶段政策法规要点见下表:
表1我国药包材监督管理发展历史
|
阶段 |
药包材政策法规 |
政策法规要点 |
|
缺少明确管理制度 |
1981年1月13日,原国家医药管理局颁布《药品包装管理办法试行》 |
该办法是针对药厂的包装工序,对药包材生产企业没有任何限制和约束。 |
|
1985年7月1日,《中华人民共和国药品管理法》实施 |
第七条规定:“生产药品所需的原料、辅料以及直接接解药品的容器和包装材料,必须符合药用要求。” |
|
|
1988年9月1日,原国家医药管理局印发修订《药品包装管理办法》施行。 |
没有对药包材生产企业进行限制和约束。 |
|
|
许可证制度 |
1992年4月1日,原国家医药管理局颁布《药品包装用材料、容器生产管理办法试行》实施。 |
规定新建生产直接接触药品的包装材料、药用玻璃瓶容器企业或车间,须按《药品包装用材料、容器生产许可证》验收通则的各项要求进行,建成后,向所在地省级医药管理部门提出申请,经评审合格者,由省级医药管理部门报国家医药管理局审核批准后,发给《药品包装用材料、容器生产企业许可证》。 |
|
1996年4月29日,原国家医药管理局颁布《直接接触药品的包装材料、容器生产质量管理规范试行》实施。 |
第一次提出药品包装材料洁净厂房的设计符合医药工业洁净厂房的设计规范,医药管理部门第一次对药包材进行了正式的认证监管,并向通过认证的企业颁发《药包材企业生产许可证》。发证机关为各省市医药管理局。 |
|
|
注册证制度 |
2000年10月1日,原国家食品药品监督管理局颁布《药品包装用材料、容器管理办法》(暂行)(局令第21号)实施。 |
将药包材按使用方式分为I/II/III三类,规定药包材须经药品监督管理部门注册并获得《药包材注册证书》或《进口药包材注册证书》后方可生产或使用。 |
|
2004年7月20日,原国家食品药品监督管理局颁布《直接接触药品的包装材料和容器管理办法》(局令第13号)实施。 |
明确由国家食品药品监督管理局对药包材实行注册审批制度,要求企业在提交申请资料时提供“与采用申报产品包装的药品共同进行的稳定性试验(药物相容性试验)研究材料” |
|
|
2014年4月30日,中国食品药品检定研究院发布《药包材生产申请技术审评资料申报要求》等六个技术审评指导原则的通知。 |
《药包材生产现场考核技术要求(试行)》是被称为国内首部“药包材GMP”。 |
|
|
关联审评审批制度 |
2015年8月13日,《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)。 |
将直接接触药品的包装材料和容器(以下简称药包材)、药用辅料由单独审批改为在审批药品注册申请时一并审评审批。 |
|
2016年8月9日,原国家食品药品监督管理总局发布了《总局关于药包材药用辅料与药品关联审评审批有关事项的公告》(2016年第134号)(以下简称134号文)。 |
自本公告发布之日起,药包材、药用辅料应按程序(见附件2)与药品注册申请关联申报和审评审批,《药包材及药用辅料申报资料要求》另行公布。各级食品药品监督管理部门不再单独受理药包材、药用辅料注册申请,不再单独核发相关注册批准证明文件. |
|
|
2017年11月30日,原国家食品药品监督管理总局发布《关于调整原料药、药用辅料和药包材审评审批事项的公告(2017年第146号)》。 |
取消药用辅料与直接接触药品的包装材料和容器(以下简称药包材)审批,原料药、药用辅料和药包材在审批药品制剂注册申请时一并审评审批。 |
|
|
2019年5月8日,中国医药包装协会官网发布《药包材生产质量管理指南》(T/CNPPA 3005-2019)实施, |
此指南被称为新的药包材GMP,是“关联审评审批制度”下的产物,制剂企业成为药包材质量的第一责任人,官方将会减少甚至不再对药包材企业进行检查,制剂企业只能通过审计手段,加强对包括药包材生产企业GMP各方面审计。 |
从对药品包装没有任何限制到实行生产企业许可制度,再到药包材的注册审批,我国药品监管部门逐渐认识到药品包装对于药品的重要性,对药包材的监管也日趋科学、规范,2016年8月9日国家食品药品监督管理总局发布了《总局关于药包材药用辅料与药品关联审评审批有关事项的公告》(2016年第134号),随后发布了《总局关于发布药包材药用辅料申报资料要求(试行)的通告》 (2016年第155号)。从此我国药包材从"注册证制度"阶段正式改革为"关联审评审批制度"阶段,前者强调"独立申报、单独审评审批",而后者强调"用到再报、关联审评审批"。除此之外,两者的本质基本相同,即均要求进行技术审评和审批。对比见下表。
表2 我国药包材原注册管理制度与关联审评审批制度的对比表
|
项目 |
药包材注册管理制度 |
药包材关联审评审批制度 |
|
申报阶段 |
可单独申报 |
不可单独申报 |
|
审评阶段 |
单独审评 |
关联审评 |
|
审批阶段 |
单独审批 |
药包材批准与否依赖于制剂 |
|
注册管理级别 |
分级注册、分类管理 |
统一由国家药监局食品药品查验中心负责技术审评 |
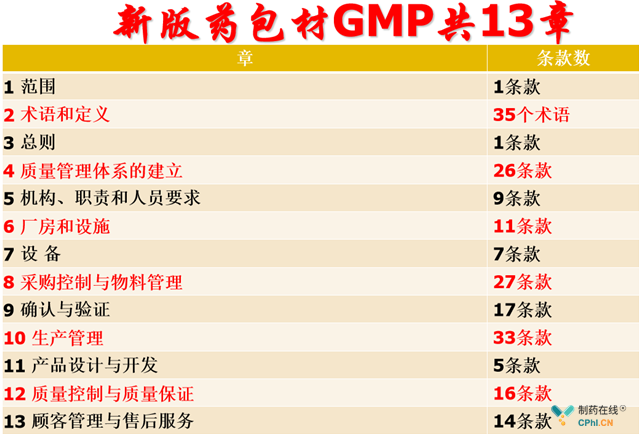
三、新版药包材GMP条款分析
新版药包材GMP共13章,条款详见下表:
四、新版药包材GMP实施关键点
1 范围关键点

2 术语和定义关键点
|
1 |
批 |
在一个过程或一系列过程中制造的药包材,期望其质量具有均一性和一致性。 |
|
2 |
批记录 |
提供批历史的文件和记录,包括产品和控制的相关信息,具有可追溯性。 |
|
3 |
批号 |
用于识别一批产品的唯一标示符号。一个批号可以是数字、字母和/或符号的组合,通过它可以识别一批产品以及确定产品的生产和分布史。 |
|
4 |
校准 |
校核或校准(与参考标准比较)一台测量仪器的准确度的过程。 |
|
5 |
洁净室 |
控制室内空气悬浮微粒的浓度的房间,其构造和使用使室内微粒的引入、产生以及保持在最小水平,控制所需的其他相关参数,例如温度、湿度和压力。 |
|
6 |
污染 |
任何不需要的物质进入包装材料中。 |
|
7 |
成品 |
完成了所有生产阶段的包装材料。 |
|
8 |
中间产品 |
完成了部分而非全部生产阶段的药包材。 |
|
9 |
原材料 |
生产包装材料所用的原始材料/组件/物质。 |
|
10 |
批准的 |
证实了的合格状态。 |
|
11 |
批放行 |
质量部门或其授权人员对批文件正式审查,并决定放行该批产品用于销售或供应。 |
|
12 |
变更控制 |
以文件形式记录的变更控制。 |
|
13 |
投诉 |
来自客户的有关缺陷和/或不一致的信息。 |
|
14 |
生产日期 |
药包材加工或制造的第一阶段、包装阶段或最终放行阶段,可与顾客协商确定。 |
|
15 |
偏差 |
与批准的SOP或确立的标准间的偏离。 |
|
16 |
过程控制 |
生产过程中确保产品符合技术规范而采取的措施。 |
|
17 |
药品 |
任何能够治疗或阻止人类或动物疾病的物质或物质组合。 |
|
18 |
超出技术规范 |
不符合技术规范的实际试验结果。 |
|
19 |
药包材 |
与药品直接接触的包装系统(含功能性次级包材)、组件、给药装置和印字包材。 |
|
20 |
加工助剂 |
利于过程实现的材料。(此类材料未包括在产品的技术规范中,且能够在最终生产阶段中将其去除,如脱模剂、压缩空气、工艺润滑剂) |
|
21 |
生产 |
产出药包材的过程。 |
|
22 |
质量控制 |
满足质量要求的质量管理的组成部分。 |
|
23 |
质量部门 |
负有QA和QC职责的组织部门。 |
|
24 |
物料平衡 |
理论上成品的数量与实际生产的或使用的数量之间的比较,允许存在正常差异。 |
|
25 |
不合格 |
原材料、加工助剂、中间产品或成品的检验表明不符合一项或多项技术规范中的要求的情况,并且通常由质量部门认定其不适宜使用。 |
|
26 |
拒收 |
由质量部门认定原材料、加工助剂、中间产品或成品不适宜使用的过程。 |
|
27 |
返工 |
重复部分生产过程。 |
|
28 |
再加工 |
使不符合的产品符合要求的活动。 |
|
29 |
留样 |
贮存材料或成品以备将来参考。 |
|
30 |
退货 |
将药包材送回企业的过程。 |
|
31 |
风险管理 |
以分析、评价、控制和监测风险为目的的管理政策、程序和执行的系统性应用。 |
|
32 |
标准操作规程 |
生产和控制目的所使用的已批准、形成文件的程序或系列程序、作业指导书和试验指导书。 |
|
33 |
无菌 |
无存活微生物的状态。 |
|
34 |
确认 |
通过提供客观证据对特定的预期用途或应用要求已得到满足的认定。 |
|
35 |
验证 |
通过提供客观证据对规定要求已得到满足的认定。 |
3 总则关键点

4 质量管理体系的建立关键点

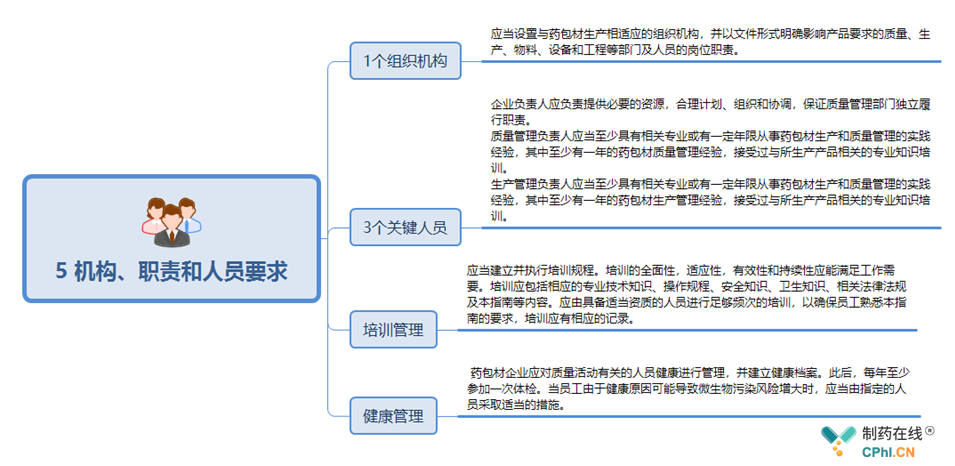
5 机构、职责和人员要求关键点
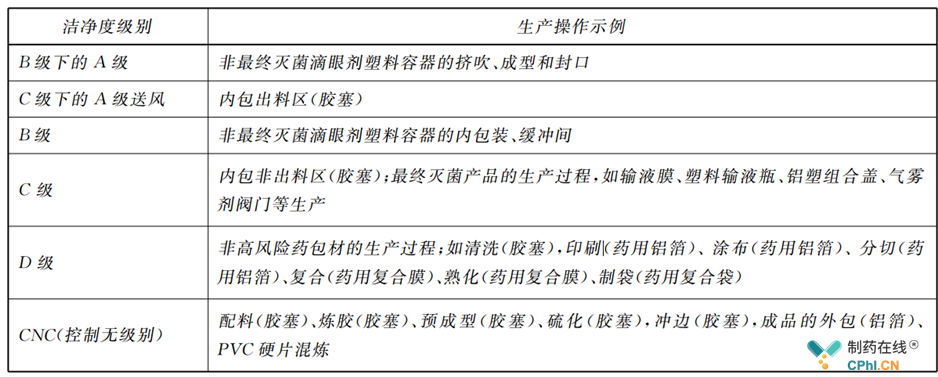
6 厂房和设施关键点(洁净级别示例)
7 设备关键点

8 采购控制与物料管理关键点
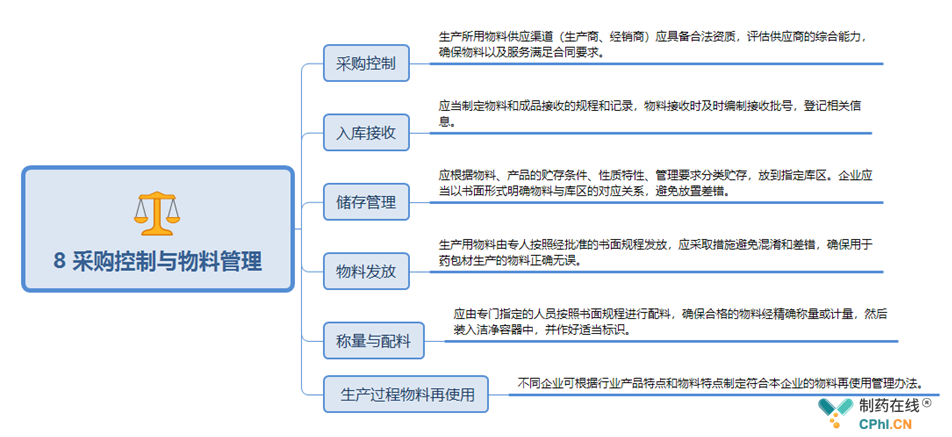
9 确认与验证关键点
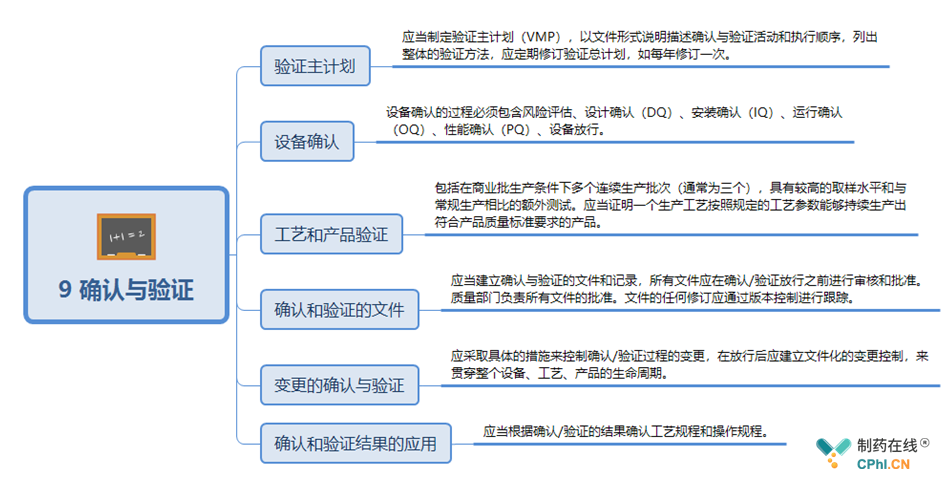
10 生产管理关键点
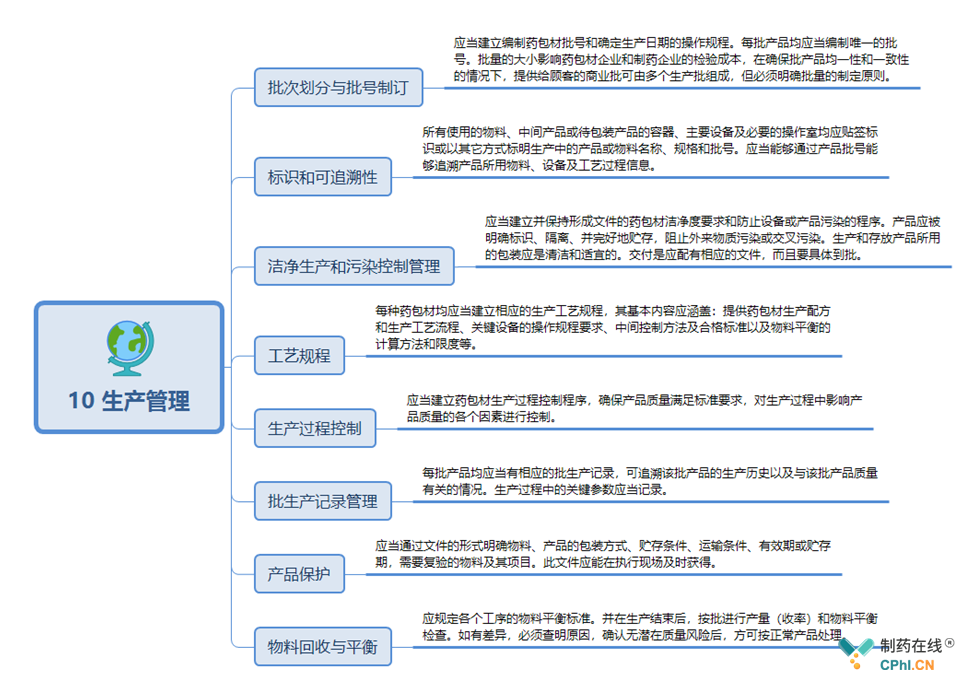
11 产品设计与开发关键点

12 质量控制与质量保证关键点

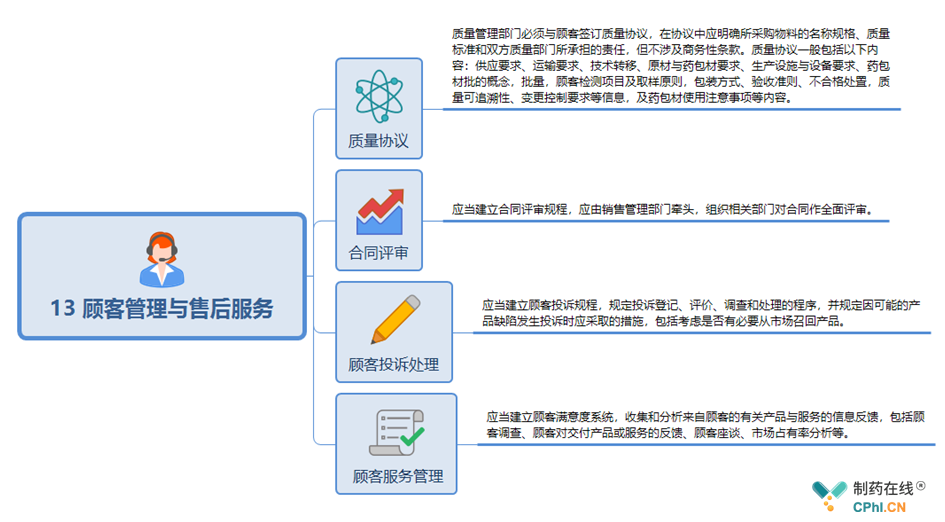
13 顾客管理与售后服务关键点
参考文献
[1] www.cnppa.org/index.php/Home/Bz/show_2019/id/992.html
[2] www.keyin.cn/magazine/yinshuajishu/201801/24-1109249.shtml
[3] wemedia.ifeng.com/65972986/wemedia.shtml
[4] www.sdaqh.gov.cn/html/2016811/n082615844.html
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。
点击下图,观众预登记成功送20元话费



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57