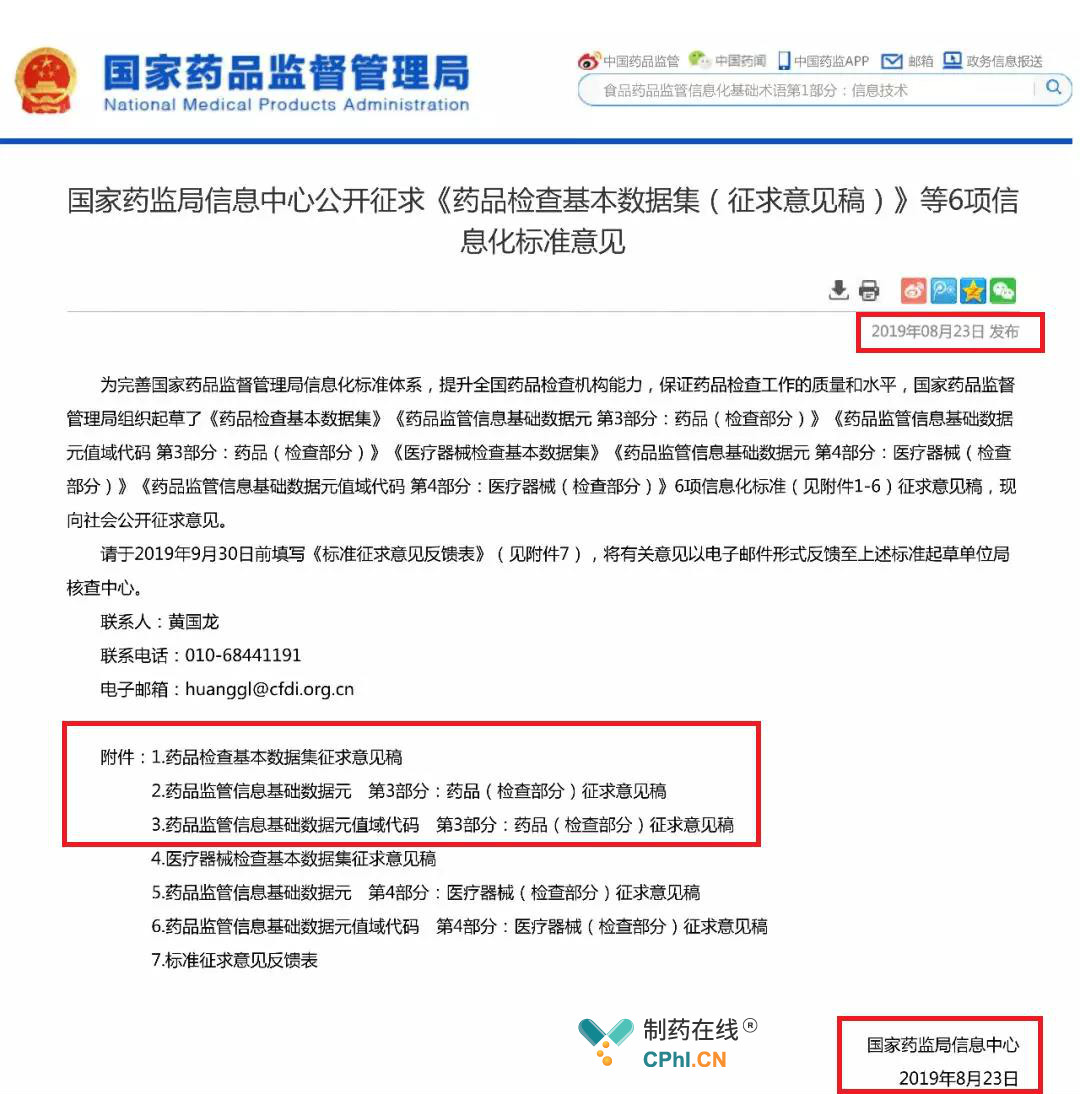
星期五发布新法规或公告,这几乎成了国家药监局的惯例了,上周五(2019年8月23日)又传来大消息,国家药监局官网发布《药品检查基本数据集》《药品监管信息基础数据元第3部分:药品(检查部分)》《药品监管信息基础数据元值域代码第3部分:药品(检查部分)》《医疗器械检查基本数据集》《药品监管信息基础数据元第4部分:医疗器械(检查部分)》《药品监管信息基础数据元值域代码第4部分:医疗器械(检查部分)》6项信息化标准的征求意见稿,此次药品监管检查3项标准文件出台,是为完善国家药品监督管理局信息化标准体系,提升全国药品检查机构能力,保证药品检查工作的质量和水平,加速建设"互联网+监管"药品检查数据库。
一、"互联网+监管"药品检查数据库建立背景
近年来,逢迎大数据时代,随着国家对医药的深入改革,由国家药监局主导的各类医药平台及数据库也在蓬勃发展当中,为促进药品监管信息系统互联互通、信息共享和业务协同提供前提条件,2013年2月制定发布了《关于进一步加强食品药品监管信息化建设的指导意见》(国食药监办〔2013〕32号),提出依据事权划分,按照统一标准,建设国家、省两级数据中心,加强数据的采集、整理、分析、应用、发布等统一管理,涵盖药品的受理、审评、审批、认证、评价、稽查、应急等全链条业务管理,实现资源整合和数据共享,为科学决策和监管提供数据支撑,目前已建立的药品相关数据库如图1,但 "信息孤岛"的问题仍然存在,国家药监局各部门药品检查信息资源难以共享。
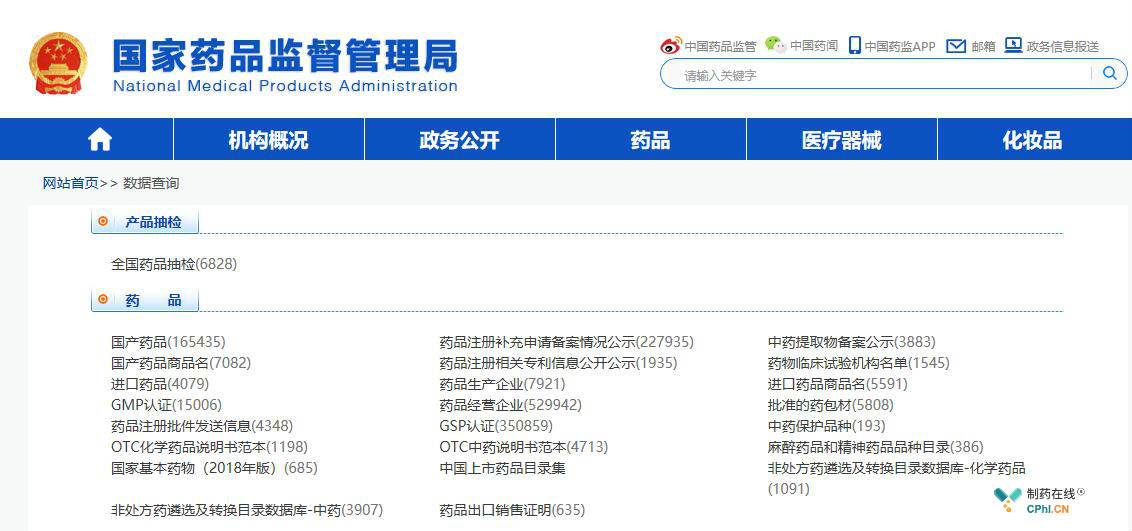
图1:目前药监局已建立的数据库(截止2019年8月)
二、"互联网+监管"药品检查数据库标准体系简介
查阅CFDAB-T-0101-2014《食品药品监管信息化标准体系》,目前药品监管信息化标准体系包括7个标准分体系:总体标准分体系、网络基础设施标准分体系、信息资源标准分体系、应用支撑标准分体系、应用标准分体系、信息安全标准分体系和信息化管理标准分体系,本次发布药品检查数据库相关的属于信息资源标准分体系。
三、"互联网+监管"药品检查数据库设计原则
"互联网+监管"药品检查数据库设计原则建议需符合CFDAB-T-0501-2014《食品药品监管数据库设计规范》的7个原则的要求,如图3所示:
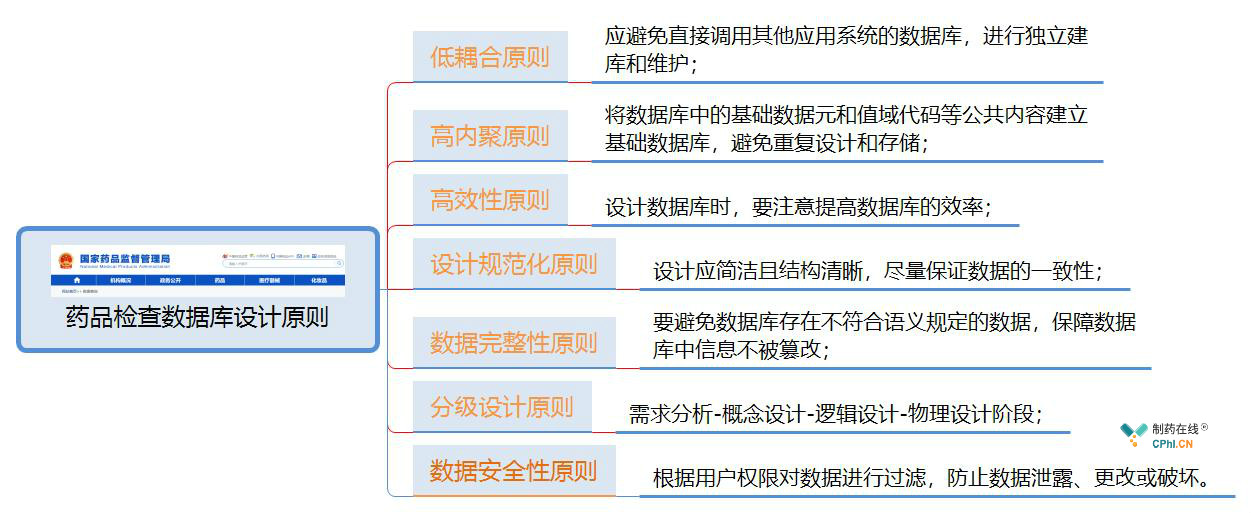
图3: 药品检查数据库设计原则
四、我国"互联网+监管"药品检查数据库建设的展望
为完善"互联网+监管"监管模式,以点带面、分层推进,进一步完善药品检查数据库,国家药监部门将建成国家、省及省以下各级监管业务平台,实现对药品临床前研究、临床试验、生产制造、经销配送等全链条药品检查数据库的管理,实现资源整合和数据共享,为科学决策和监管提供数据支撑,2019年8月23日国家药监局官网发布《药品检查基本数据集》信息化标准征求意见稿,主要涉及药物GCP/药物GLP有因检查、药物GCP机构资格认定检查、药物临床试验数据现场核查、一次性**临床试验机构资格认定检查、**临床试验注册现场检查、药品注册生产现场检查、药品GMP飞行检查、进口药品境外生产现场检查、药品检查观察共9个药品检查工作程序相关数据库的建设,需要关注的信息数据子集分析如下:
♦ 药品临床前研究、临床试验阶段
|
药品检查类别 |
序号 |
信息数据子集 |
|
药物GCP机构资格认定检查工作程序 |
1 |
药物GCP机构资格认定资料技术审查意见信息数据子集 |
|
2 |
药物GCP机构资格认定补充资料通知信息数据子集 |
|
|
3 |
药物GCP机构资格认定现场检查方案信息数据子集 |
|
|
4 |
药物GCP机构资格认定现场检查通知信息数据子集 |
|
|
5 |
承诺书信息数据子集 |
|
|
6 |
药物GCP机构资格认定现场检查综合评定意见信息数据子集 |
|
|
7 |
药物GCP机构资格认定评分表意见信息数据子集 |
|
|
8 |
药物GCP机构资格认定现场检查意见表信息数据子集 |
|
|
9 |
药品注册临床试验项目核查报告信息数据子集 |
|
|
10 |
药物GCP机构资格认定检查员评估表信息数据子集 |
|
|
11 |
药物GCP机构资格认定检查报告集体审查意见表信息数据子集 |
|
|
12 |
药物GCP机构资格认定审核件信息数据子集 |
|
|
13 |
《药物GCP现场检查审核件》转局登记单信息数据子集 |
|
|
药物GCP/药物GLP有因检查程序 |
1 |
药物GLP/GCP有因检查方案信息数据子集 |
|
2 |
药物GCP/GLP有因检查通知信息数据子集 |
|
|
3 |
药物GCP/GLP有因检查报告信息数据子集 |
|
|
4 |
药物GCP有因检查报告集体审查意见表信息数据子集 |
|
|
5 |
药物GCP/GLP有因检查审核件信息数据子集 |
|
|
药物临床试验数据现场核查工作程序 |
1 |
药物临床试验数据核查方案信息数据子集 |
|
2 |
关于药物临床试验数据现场核查的通知信息数据子集 |
|
|
3 |
药物临床实验数据现场核查不合格项目信息数据子集 |
|
|
4 |
药物临床试验数据现场核查报告信息数据子集 |
|
|
5 |
无利益冲突说明信息数据子集 |
|
|
6 |
药物临床试验数据核查专家会审表信息数据子集 |
|
|
7 |
药物临床实验数据核查审核报告信息数据子集 |
|
|
8 |
药物临床试验数据现场核查归档资料-卷内文件目录信息数据子集 |
|
|
9 |
药物临床试验数据自查报告归档资料-卷内文件目录信息数据子集 |
|
|
10 |
技术档案交接单信息数据子集 |
|
|
一次性**临床试验机构资格认定检查工作程序 |
1 |
一次性**临床试验机构资格认定资料技术审查意见信息数据子集 |
|
2 |
一次性**临床试验机构资格认定补正通知信息数据子集 |
|
|
3 |
一次性**临床试验机构资格认定现场检查通知信息数据子集 |
|
|
4 |
一次性**临床试验机构资格认定现场检查方案信息数据子集 |
|
|
5 |
一次性**临床试验机构资格认定现场综合评定意见信息数据子集 |
|
|
6 |
一次性**临床试验机构资格认定现场检查发现问题信息数据子集 |
|
|
7 |
一次性**临床试验机构资格认定检查要点—负责机构信息数据子集 |
|
|
8 |
一次性**临床试验机构资格认定检查要点—试验现场信息数据子集 |
|
|
9 |
一次性**临床试验机构资格认定检查要点—伦理委员会信息数据子集 |
|
|
10 |
一次性**临床试验机构资格认定集体审查意见表信息数据子集 |
|
|
11 |
一次性**临床试验机构资格认定审核件信息数据子集 |
|
|
12 |
一次性**临床试验机构资格认定整改通知信息数据子集 |
|
|
13 |
《GCP现场检查审核件》转局登记单信息数据子集 |
♦ 生产制造阶段
|
药品检查类别 |
序号 |
信息数据子集 |
|
**临床试验注册现场检查工作程序 |
1 |
**临床试验注册现场检查接收资料信息数据子集 |
|
2 |
**临床试验注册现场检查资料技术审查意见信息数据子集 |
|
|
3 |
**临床试验注册现场检查工作方案信息数据子集 |
|
|
4 |
**临床试验注册现场检查通知书信息数据子集 |
|
|
5 |
**临床试验注册现场检查报告信息数据子集 |
|
|
6 |
**临床试验现场检查发现问题信息数据子集 |
|
|
7 |
**临床试验注册现场检查集体审查意见表信息数据子集 |
|
|
8 |
**临床试验注册现场检查审核件信息数据子集 |
|
|
药品注册生产现场检查工作程序 |
1 |
药品生产现场检查告知书信息数据子集 |
|
2 |
药品注册生产现场检查告知材料交接单信息数据子集 |
|
|
3 |
药品注册生产现场检查资料预审查表信息数据子集 |
|
|
4 |
药品注册生产现场检查申请表信息数据子集 |
|
|
5 |
药品注册生产现场检查终结告知信息数据子集 |
|
|
6 |
药品注册生产现场检查资料审查表信息数据子集 |
|
|
7 |
药品注册生产现场检查方案信息数据子集 |
|
|
8 |
药品注册生产现场检查通知信息数据子集 |
|
|
9 |
药品注册生产现场检查安排表信息数据子集 |
|
|
10 |
药品注册生产现场检查抽样记录表信息数据子集 |
|
|
11 |
药品注册检验通知书信息数据子集 |
|
|
12 |
药品注册现场抽样封签信息数据子集 |
|
|
13 |
药品注册生产现场检查劳务费表信息数据子集 |
|
|
14 |
承诺书信息数据子集 |
|
|
15 |
药品注册生产现场检查组携带物品清单信息数据子集 |
|
|
16 |
药品注册生产现场检查报告信息数据子集 |
|
|
17 |
药品注册生产现场检查报告审核意见信息数据子集 |
|
|
药品GMP飞行检查工作程序 |
1 |
**药业有限公司药品GMP飞行检查方案信息数据子集 |
|
2 |
药品GMP飞行检查通知信息数据子集 |
|
|
3 |
药品GMP飞行检查报告信息数据子集 |
|
|
4 |
药品GMP飞行检查不合格项目信息数据子集 |
|
|
5 |
药品GMP飞行检查审核件信息数据子集 |
♦ 境外检查
|
药品检查类别 |
序号 |
信息数据子集 |
|
进口药品境外生产现场检查工作程序 |
1 |
关于请提出**年进口药品境外生产现场检查备选品种的函信息数据子集 |
|
2 |
**年进口药品境外生产现场检查备选品种概况信息数据子集 |
|
|
3 |
**年进口药品境外生产现场检查年度任务信息数据子集 |
|
|
4 |
**年进口药品境外生产现场检查任务公告信息数据子集 |
|
|
5 |
通气会告知书信息数据子集 |
|
|
6 |
进口药品境外生产现场检查基本情况信息数据子集 |
|
|
7 |
关于选派人员参加进口药品境外生产现场检查的函信息数据子集 |
|
|
8 |
进口药品境外生产现场检查选派人员名单信息数据子集 |
|
|
9 |
**年度进口药品境外现场检查安排计划表信息数据子集 |
|
|
10 |
关于调派国家药品GMP检查员执行进口药品境外生产现场检查任务的函信息数据子集 |
|
|
11 |
进口药品境外生产现场检查资料签收单信息数据子集 |
|
|
12 |
进口药品境外生产现场检查资料审查意见信息数据子集 |
|
|
13 |
进口药品境外生产现场检查补充资料通知信息数据子集 |
|
|
14 |
进口药品境外生产现场检查方案信息数据子集 |
|
|
15 |
检查计划信息数据子集 |
|
|
16 |
现场检查通知信息数据子集 |
|
|
17 |
药品注册检验通知书信息数据子集 |
|
|
18 |
相关单位现场检查劳务费表信息数据子集 |
|
|
19 |
进口药品境外生产现场检查报告-报中心信息数据子集 |
|
|
20 |
进口药品境外生产现场检查报告-发被检单位信息数据子集 |
|
|
21 |
检查报告发出信信息数据子集 |
|
|
22 |
进口药品境外检查结果报告信息数据子集 |
|
|
23 |
进口药品境外检查结果报告交接单信息数据子集 |
|
|
24 |
进口药品境外检查结果报告交接单-附件1文件需求表信息数据子集 |
|
|
25 |
进口药品境外检查结果报告交接单-附件5文件转交登记表信息数据子集 |
|
|
药品检查观察工作程序 |
1 |
外部药品检查计划交接单信息数据子集 |
|
2 |
药品检查观察合账信息数据子集 |
|
|
3 |
关于对境外检查机构检查工作进行现场观察的函信息数据子集 |
|
|
4 |
关于选派人员对境外检查机构检查工作进行现场观察的函信息数据子集 |
|
|
5 |
机构对中国企业进行GMP(或其他)检查的观察报告信息数据子集 |
|
|
6 |
机构对中国企业进行GMP(或其他)检查的观察报告-1检查概况信息数据子集 |
|
|
7 |
机构对中国企业进行GMP(或其他)检查的观察报告-2检查过程与内容信息数据子集 |
|
|
8 |
机构对中国企业进行GMP(或其他)检查的观察报告-3检查缺陷项信息数据子集 |
|
|
9 |
年度国外药品检查观察总结报告-文件修订申请表信息数据子集 |
|
|
10 |
年度国外药品检查观察总结报告-文件转交登记表信息数据子集 |
值得注意的是,以上药品检查数据库中没有药品GMP/GSP认证检查相关数据集,为贯彻落实国务院深化简政放权、放管结合、优化服务改革的要求,将在《药品管理法》表决后,计划取消药品生产质量管理规范(GMP)认证、药品经营质量管理规范(GSP)认证制度,取消GMP/GSP认证,将会给整个医药行业带来什么样的变化?这些都值得深思,其实,取消GMP/GSP认证,虽然企业在行政或流程上减少了一些手续,但随着国家药监局大批量招兵买马,一批职业化专业化的检查队伍将会随时出现在生产现场,飞行检查/有因检查/延伸检查/专项检查等将成为常态,而许可检查(临床试验数据核查、药品注册生产现场核查等)必然会越来越严格,药品生产和经营企业需要做的就是经得住考验,将无GMP/GSP证书的GMP/GSP做到常态化。
参考文献:
[1] www.nmpa.gov.cn/WS04/CL2101/357660.html
[2] www.nmpa.gov.cn/WS04/CL2166/
[3] www.gov.cn/gzdt/2013-02/20/content_2336510.htm
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57