2019年9月18日,国家药品监督管理局官网发布《晚期非小细胞肺癌临床试验终点技术指导原则》,一石激起千层浪,对晚期非小细胞肺癌临床试验药物开发、试验单位具有深远的意义,弥补了我国对晚期非小细胞肺癌临床试验术在法规层面和技术层面的空白,本文梳理了《晚期非小细胞肺癌临床试验终点技术指导原则》起草进程中广受社会各界关注的五个关键点。
一、为什么要起草《晚期非小细胞肺癌临床试验终点技术指导原则》?
肺癌的发病率和病死率居全球和中国恶性肿瘤之首,非小细胞肺癌(non-small cell lung cancer,NSCLC)占肺癌总体的85%,大部分初诊时已为晚期,晚期NSCLC为抗肿瘤新药研发的热点领域,创新药物众多,临床证据链日趋复杂,涌现出了复杂的终点指标和研究设计--包括替代终点、中间临床终点和其它创新终点;并出现共同终点平行检验、复合终点序贯检验等复杂设计,现有晚期非小细胞肺癌临床试验终点技术指导原则尚不能涵盖,因此,国家药品监督管理局药品审评中心组织国内肺癌相关临床和审评专家起草了本指导原则,旨在阐述当前晚期NSCLC临床试验终点的一般性设计与审评考虑,期望为抗肿瘤药物研发人员在晚期肺癌的临床试验设计和终点选择上提供参考,科学、高效地确定药物疗效,提高临床研发效率,使患者更早获益。
二、《晚期非小细胞肺癌临床试验终点技术指导原则》起草历程
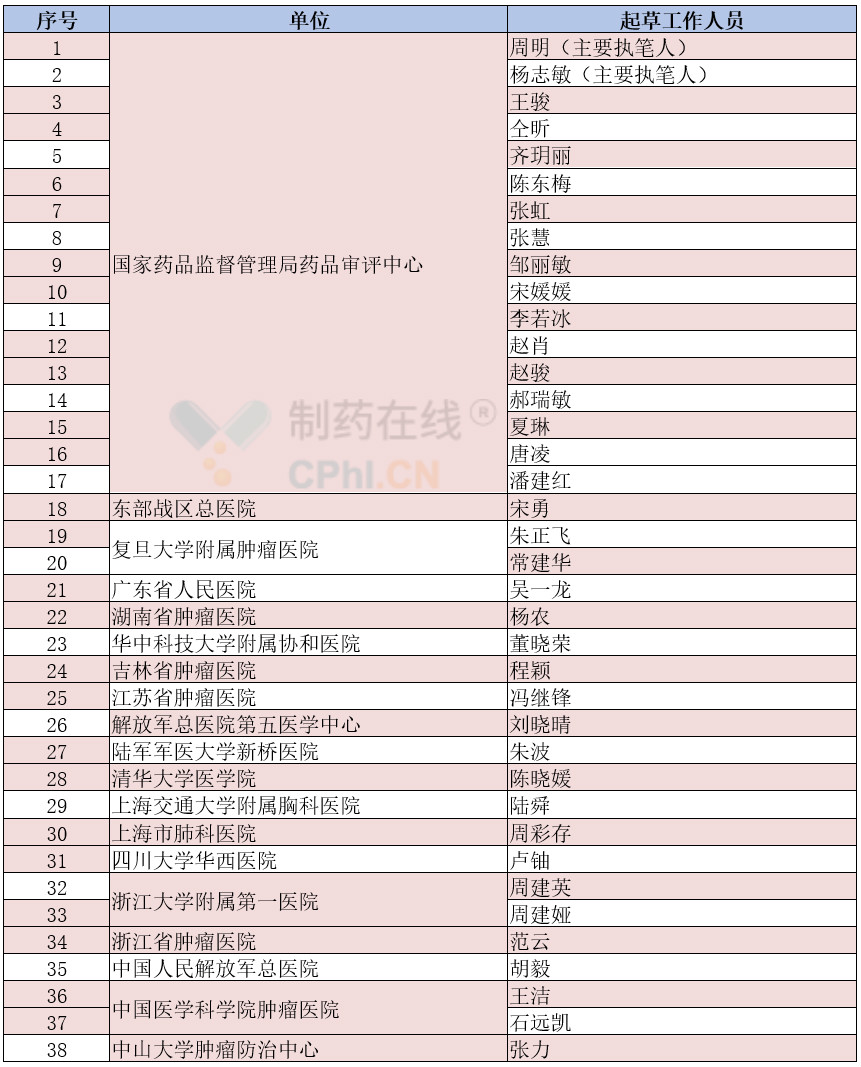
《晚期非小细胞肺癌临床试验终点技术指导原则》由国家药品监督管理局药品审评中心牵头,2017年初立项,成立起草工作小组,由学术界临床专家和监管机构代表组成(见表1),2年多来,召开了多次专家讨论会,听取业界意见,经广泛调研和专家讨论,不断反复地沟通,在保证质量的前提下,努力地、高效率地完成《晚期非小细胞肺癌临床试验终点技术指导原则》。
表1 :起草工作小组清单
三、晚期非小细胞肺癌药物临床试验的常用终点分类更科学
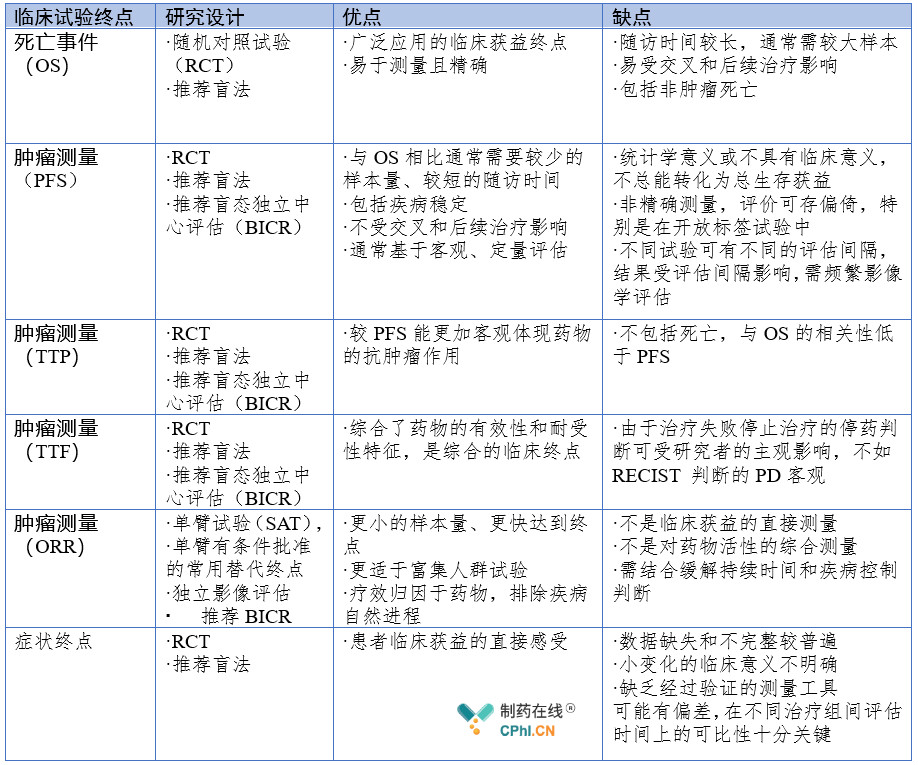
《晚期非小细胞肺癌临床试验终点技术指导原则》在"抗肿瘤药物临床试验的常用终点"部分介绍了晚期非小细胞肺癌药物临床试验终点的3种分类,分别是基于死亡事件、肿瘤测量和症状评估,并概括了3种分类优缺点,详见表2。
表2:晚期非小细胞肺癌药物常用临床试验终点比较表
四、晚期非小细胞肺癌新药注册临床试验的设计及终点考虑
《晚期非小细胞肺癌临床试验终点技术指导原则》在"晚期非小细胞肺癌新药注册临床试验的设计及终点考虑"部分,结合我国肺癌人群驱动基因突变高发的流行病学特点,以研究人群是否以肿瘤疗效预测生物标志物富集为考虑,对富集人群和非富集人群的研究设计及终点选择予以建议。对适用于单臂加速有条件批准的研究终点及适用条件予以明确。
五、晚期非小细胞肺癌新药注册临床试验主要终点获益考虑
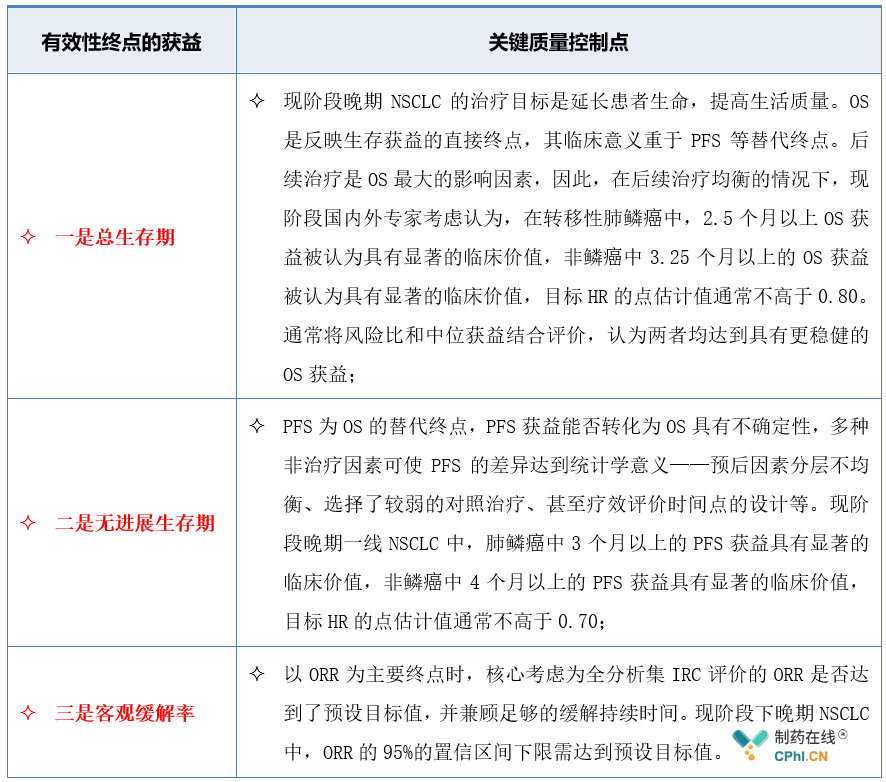
《晚期非小细胞肺癌临床试验终点技术指导原则》在"晚期非小细胞肺癌新药注册临床试验主要终点获益考虑"部分,对当前不同设计的有效性终点的获益考虑予以明确,详见表3。
表3:晚期非小细胞肺癌新药注册临床试验主要终点获益考虑要点
晚期NSCLC是抗肿瘤药物的研发热点,伴随新药研发,晚期NSCLC治疗的证据链日益丰富,药物临床试验的设计和终点选择趋于复杂,现阶段下出台落地的《晚期非小细胞肺癌临床试验终点技术指导原则》(2019年第64号)将推动抗肿瘤产品的研发,鼓励申请人与监管机构沟通并探索创新的试验设计和研究终点。
备注:本文引用英文缩写
♦ 非小细胞肺癌(non-small cell lung cancer,NSCLC)
♦ 总生存期(overall survival,OS)
♦ 客观缓解率(objective response rate,ORR)
♦ 无进展生存期(progression free survival,PFS)
♦ 随机对照试验(randomized controlled trials,RCT)
♦ 盲态独立中心评估(Blinded Independent Central Review,BICR)
♦ 单臂试验(single arm trial,SAT)
♦ 独立评审委员会(independent review committee,IRC)
♦ 免疫治疗疗效评价标准(immune response evaluation criteria in solid tumors,iRECIST)
♦ 药效学(pharmacodynamics,PD)
参考文献
[1] www.nmpa.gov.cn/WS04/CL2138/358467.html
[2] www.cde.org.cn/news.do?method=largeInfo&id=314878
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57