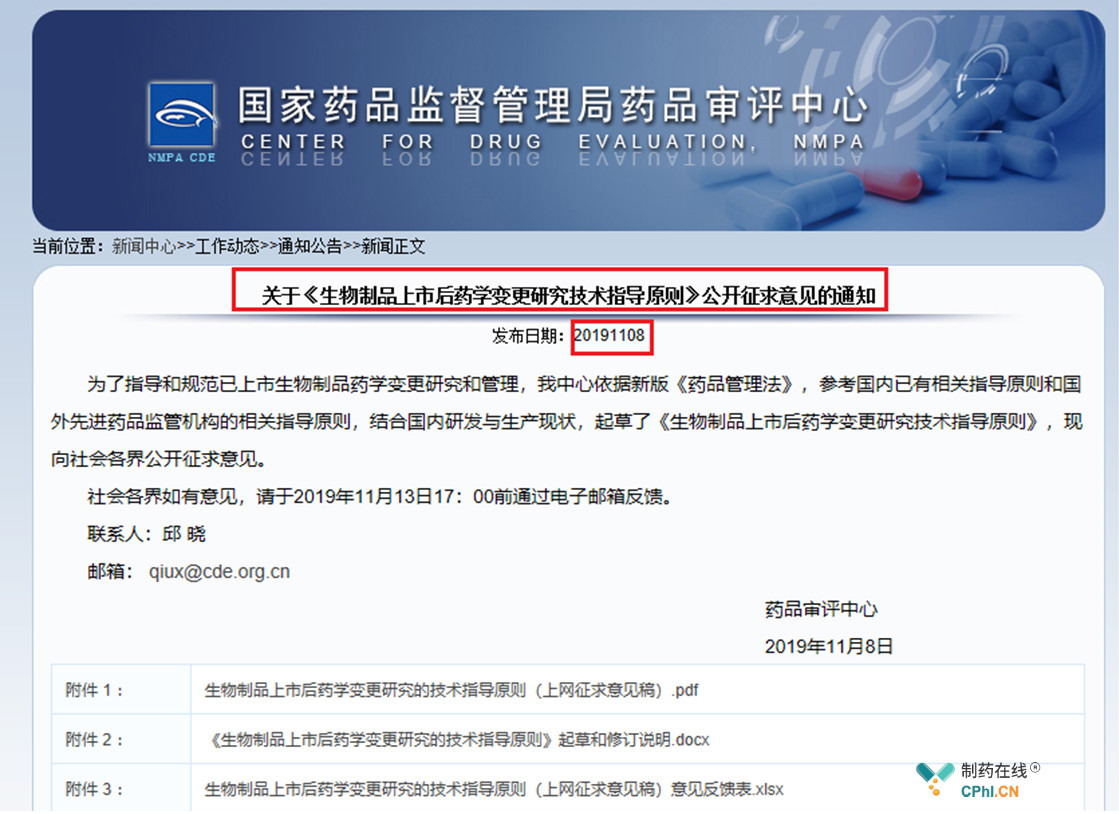
意外,2019年11月8日,国家药品监督管理局药品审评中心再放大招,官网发布《生物制品上市后药学变更研究技术指导原则》征求意见稿等多个变更指导原则,征求意见截止时间大部分只留了5天,一石激起千层浪,对国内医药各行业具有深远的意义,尤其《生物制品上市后药学变更研究技术指导原则》,这是自2005年原国家食品药品监督管理局发布的《生物制品生产工艺过程变更管理技术指导原则》【国食药监注[2005]493号】以来的首次调整,生物制品上市后生产工艺变更的监管将成生物制品行业洗牌新"杀器",生物制品安全,关乎民生,本文梳理了《生物制品上市后药学变更研究技术指导原则》征求意见公示稿起草进程中广受社会各界关注的三个热点。
一、为什么要修订《生物制品上市后药学变更研究技术指导原则》?
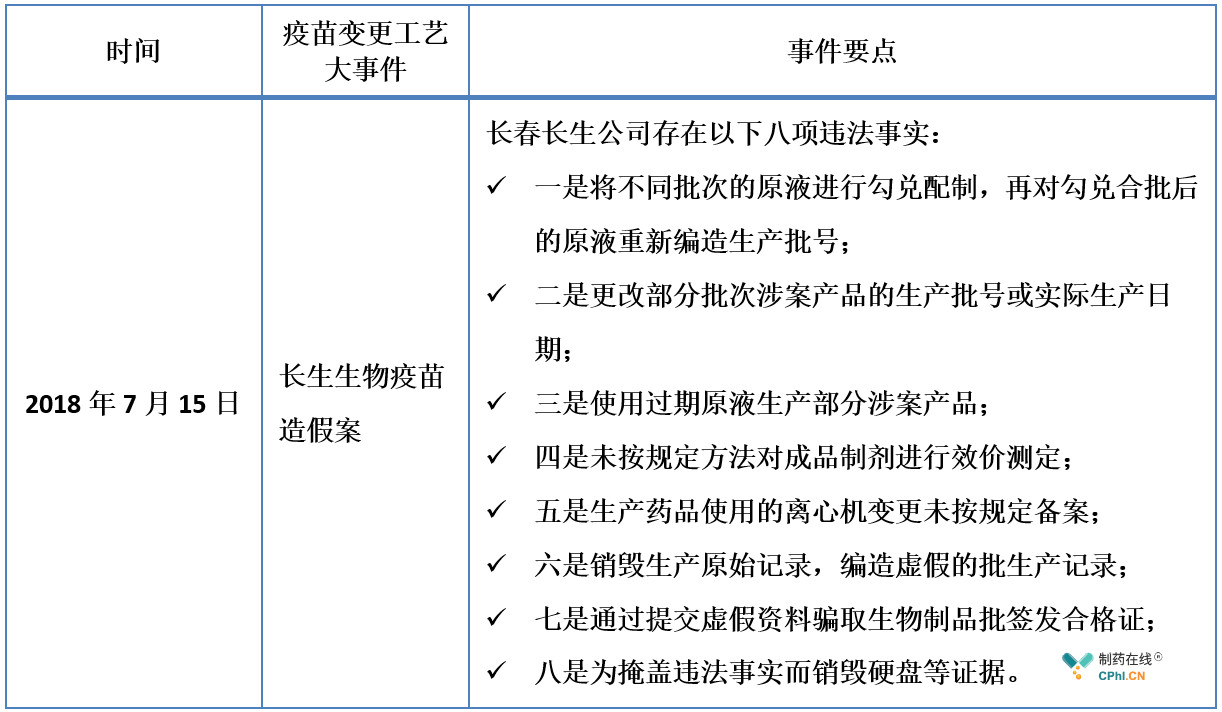
我国生物制品上市后变更的相关技术要求相对薄弱,14年前,即2005年颁布的《生物制品生产工艺过程变更管理技术指导原则》【国食药监注[2005]493号】以分类为主,但分类过于笼统且缺少明确的分类原则,也没有提供详细的资料要求,可执行性不够,不能满足现生物制品行业的变更控制需求,2018年长生生物**造假案,暴露出部分企业存在变更研究水平及风险控制水平参差不齐、对变更控制和管理的重视不够、开展相关研究不充分等问题,基于上述原因,药审中心从全方位完善**技术指南体系为出发点,举一反三,堵塞漏洞,本着鼓励持有人持续改进工艺,提高和保障生物制品质量的目标,组织修订了《生物制品上市后药学变更研究技术指导原则》和制定了《**上市后生产工艺变更技术指导原则》。
二、《生物制品上市后药学变更研究技术指导原则》亮点抢先看
2.1 适用范围

2.2 定位
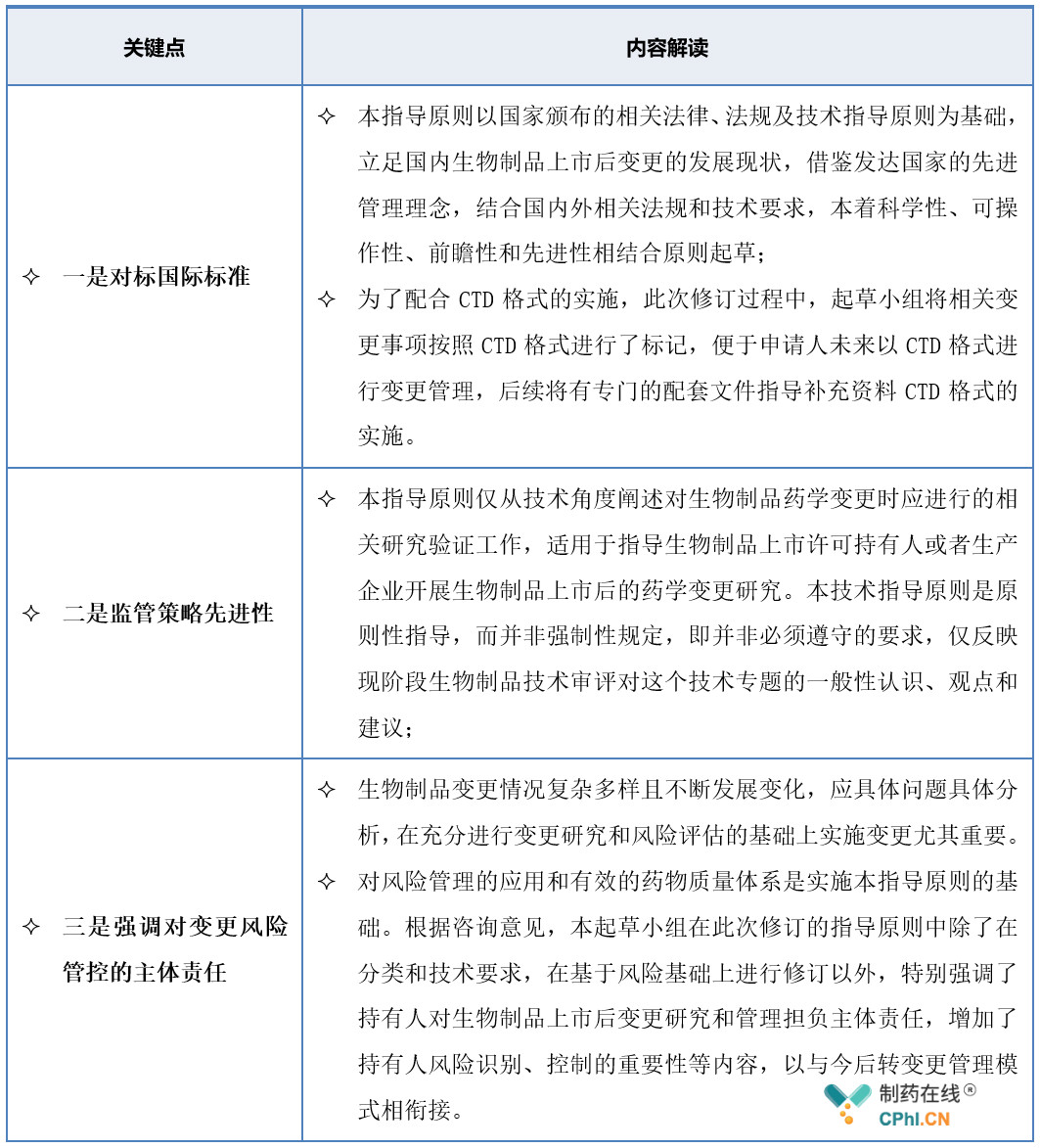
2.3 变更分类更科学

本指导原则中对各变更事项风险评估分级是在基于科学和风险的基础上,按照2019年10月发布的《药品注册管理办法》(征求意见稿)分为三类,分类的过程中参考了WHO、FDA、EMA等发布的相关指导原则,因此原则上对各项变更事项的风险分级与国际共识保持一致,《生物制品上市后药学变更研究技术指导原则》按生物制品药学变更可能对安全性、有效性和质量可控性的风险和产生影响的程度,将生物制品上市后生产工艺变更由高至低划分为三类:
三、变更控制监管法规体系分析
1、新版《药品管理法》(2019年修订第31号主席令)第七十九条规定:对药品生产过程中的变更,按照其对药品安全性、有效性和质量可控性的风险和产生影响的程度,实行分类管理。属于重大变更的,应当经国务院药品监督管理部门批准,其他变更应当按照国务院药品监督管理部门的规定备案或者报告。药品上市许可持有人应当按照国务院药品监督管理部门的规定,全面评估、验证变更事项对药品安全性、有效性和质量可控性的影响。
2、新版《药品管理法》(2019年修订第31号主席令)第一百二十四条规定:违反本法规定,有下列行为之一的,没收违法生产、进口、销售的药品和违法所得以及专门用于违法生产的原料、辅料、包装材料和生产设备,责令停产停业整顿,并处违法生产、进口、销售的药品货值金额十五倍以上三十倍以下的罚款;货值金额不足十万元的,按十万元计算;情节严重的,吊销药品批准证明文件直至吊销药品生产许可证、药品经营许可证或者医疗机构制剂许可证,对法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入百分之三十以上三倍以下的罚款,十年直至终身禁止从事药品生产经营活动,并可以由公安机关处五日以上十五日以下的拘留。(七)未经批准在药品生产过程中进行重大变更。
3、新版《药品管理法》(2019年修订第31号主席令)第一百二十七条规定:违反本法规定,有下列行为之一的,责令限期改正,给予警告;逾期不改正的,处十万元以上五十万元以下的罚款:未按照规定对药品生产过程中的变更进行备案或者报告;
目前已出台落地的新版《药品管理法》(2019年修订第31号主席令)及还未落地的《生物制品上市后药学变更研究技术指导原则》、《**上市后生产工艺变更技术指导原则》征求意见稿可以明显的体现出来,国内药监局意识到了生物制品上市后生产工艺变更控制对风险控制的重要性和必要性,正在积极地通过整个法律法规体系的修正完善以及重构,建立对生物制品上市后生产工艺变更进行控制的完善的体系行动,希望《生物制品上市后药学变更研究技术指导原则》尽快落地,明确各类变更的研究资料要求,指导生物制品企业开展上市后变更研究与申报。
参考文献
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=314973
[2] www.sohu.com/a/142883952_195890
[3] finance.sina.com.cn/roll/2018-10-16/doc-ifxeuwws4973470.shtml
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57