2019年12月11日,国家药品监督管理局官网发布《药品经营监督管理办法》(修订草案征求意见稿),这是继发布2019年9月30日(第一版)、10月15日(第二版)后,国家药品监督管理局发布的第三版药品经营监督管理办法(征求意见稿)》,再次向社会公开征求意见,意见反馈截止日期为2019年12月20日,新版《药品经营监督管理办法》草案共七章74条,可通过联网核查营业执照等等新业态、新模式的出现给经济发展注入了活力,也对传统经营监管模式提出了挑战。
一、加速推进"放管服"改革
"放管服"改革旨在推动政府职能深刻转变,使市场在资源配置中起决定性作用和更好发挥政府作用,这是一场重塑政府和市场关系、刀刃向内的政府自身革命,也是近年来实现经济稳中向好的关键一招,2018年6月28日李克强在全国深化"放管服"改革转变政府职能电视电话会议上发布讲话,要求有关部门落实"放管服"改革,国家药品监督管理局为适应药品经营监督管理新形势和新的药品监管体制,进一步"自我革命",2019年年初,国家药监局正式启动《药品经营监督管理办法》的修订工作,组建起草专班,计划将《药品经营许可证管理办法》(原国家食品药品监督管理局第6号令)和《药品流通监督管理办法》(原国家食品药品监督管理局第26号令)进行整合,制定更具针对性和操作性的《药品经营监督管理办法》(以下简称《办法》),全面落实新修订《药品管理法》要求,进一步细化明确药品经营环节监管事权、工作要求和各方责任,确保经营环节药品质量安全,这是继发布2019年9月30日(第一版)、10月15日(第二版)后,国家药品监督管理局发布的第三版药品经营监督管理办法(征求意见稿)》。
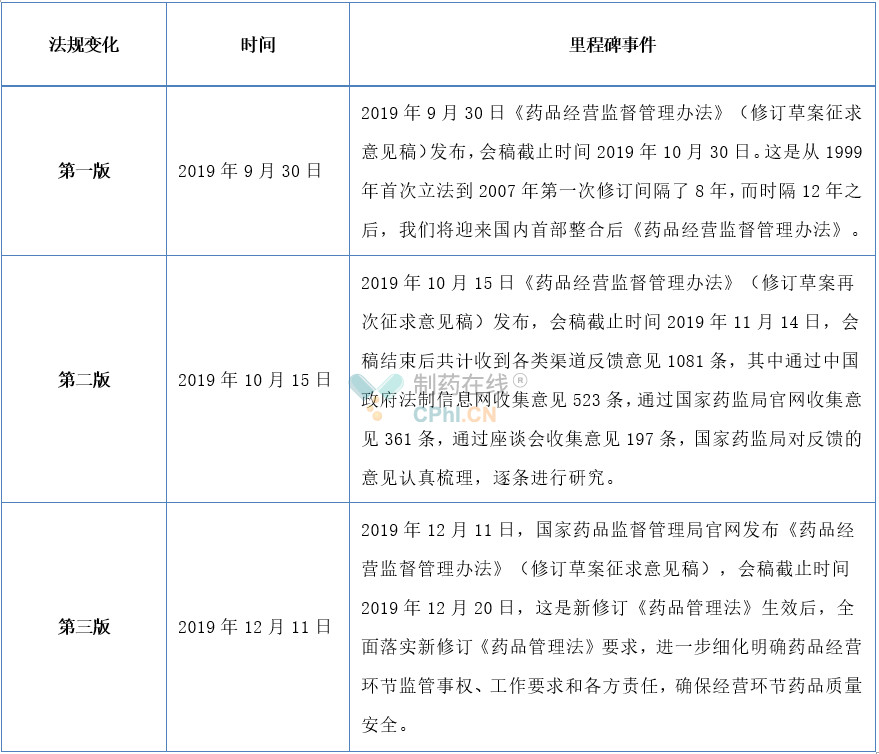
二、三版本《药品经营监督管理办法》章节对照看
《药品生产监督管理办法》修订工作坚决落实"四个最严"要求,在修订过程中,注重对标国际先进经验,结合国内实际,突出问题导向,深入研究当前我国药品经营环节监管工作实际,尽可能使《药品经营监督管理办法》具有良好的操作性,更好满足药品经营监督管理需要,三版本《药品经营监督管理办法》章节内容也在发生变化,对照如下:
三版本《药品经营监督管理办法》章节对照表
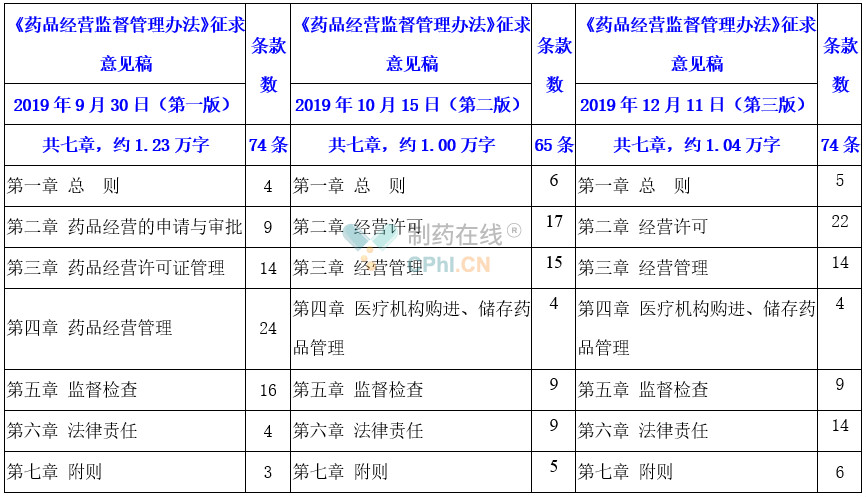
三、三版本简化药品经营企业开办程序对照看
在落实"放管服"方面,《办法(征求意见稿)》简化了药品经营企业开办程序,取消了筹建审批、经营质量管理认证等规定,进一步压缩审批时间,新开办药品经营企业整体审批时间压缩近50%;企业提交申请资料时,可通过联网核查营业执照等资料,简化了手续;购销药品时,企业可审核并留存企业资质、品种资质、购销凭证等电子版资料,有效节省了资源,减少了企业负担。
简化药品经营企业开办程序对照表
|
《药品经营监督管理办法》征求意见稿 |
《药品经营监督管理办法》征求意见稿 |
《药品经营监督管理办法》征求意见稿 |
|
2019年9月30日(第一版) |
2019年10月15日(第二版) |
2019年12月11日(第三版) |
|
第十二条【许可证申请程序】开办药品经营企业按照以下程序办理《药品经营许可证》: (一)申办人向拟办企业所在地药品监督管理部门提出开办申请,并提交以下材料: 1.药品经营许可证申请表; 2.营业执照(可联网核查); 3.拟办企业组织机构情况; 4.拟办企业法定代表人、企业负责人、质量负责人、质量管理部门负责人学历证明原件、复印件及个人简历; 5.执业药师或药学技术人员资格证书(证明文件)及聘书; 6.拟经营药品的范围; 7.拟办企业质量管理文件及陈列、仓储的设施设备目录; 8.拟设营业场所、设施设备、仓储地址及周边卫生环境等情况,仓库平面布置图及房屋产权或使用权证明。 申办人应当对其申请材料全部内容的真实性负责。 (二)药品监督管理部门对申办人提出的申请,应当根据下列情况分别作出处理: 1.申请事项不属于本部门职权范围的,应当即时作出不予受理的决定,发给《不予受理通知书》,并告知申办人向有关部门申请。 2.申请材料存在可以当场更正错误的,应当允许申办人当场更正。 3.申请材料不齐或者不符合法定形式的,应当当场或者在5个工作日内发给申办人《补正材料通知书》,一次性告知需要补正的全部内容。逾期不告知的,自收到申请材料之日起即为受理。 4.申请事项属于本部门职权范围,材料齐全、符合法定形式,或者申办人按要求提交全部补正材料的,发给申办人《受理通知书》。《受理通知书》中注明的日期为受理日期。 (三)药品监督管理部门自受理申请之日起60个工作日内,对申报材料进行审查,并依据验收细则组织现场检查。 (四)现场检查结束后,药品监督管理部门应当将现场检查结果向社会公示,公示期不少于5个工作日。公示结束后,药品监督管理部门应当在10个工作日内作出审核结论。公示期内,如有投诉、举报的,药品监督管理部门应当组织调查核实,并根据调查核实结果,再作出审核结论。 符合条件的,予以批准,并自书面批准决定作出之日起5个工作日内核发《药品经营许可证》;不符合条件的,应当书面通知申办人并说明理由,同时告知申办人享有依法申请行政复议或提起行政诉讼的权利。 现场检查、调查核实或企业整改的时间,不计入审批时限。 |
第十一条 【许可证申请资料】药品经营企业申请人向拟办企业所在地药品监督管理部门提交以下资料: (一)药品经营许可证申请表; (二)营业执照(可联网核查); (三)拟办企业组织机构情况; (四)拟办企业法定代表人、企业负责人、质量负责人、质量管理部门负责人学历证明原件、复印件及个人简历; (五)执业药师或药学技术人员资格证书(证明文件)及聘书或任命文件; (六)拟经营药品的范围; (七)拟办企业质量管理文件及陈列、仓储的设施设备目录; (八)拟设营业场所、设施设备、仓储地址及周边卫生环境等情况,仓库平面布置图及房屋产权或使用权证明。 申请人应当对其申请材料全部内容的真实性负责。
第十二条【审核批准】药品监督管理部门自受理申请之日起30个工作日内,对申请材料进行审查,并依据检查细则组织现场检查。 经材料审查和现场检查,符合条件的,予以批准,并自批准决定作出之日起5个工作日内核发药品经营许可证;不符合条件的,应当书面通知申请人并说明理由,同时告知申请人享有依法申请行政复议或提起行政诉讼的权利。 现场检查、企业整改的时间,不计入审批时限。 |
第十条【申请材料】开办药品零售企业、开办药品零售连锁经营企业总部和药品批发企业的,应当依管理权限向企业所在地市县级或者省、自治区、直辖市药品监督管理部门提交下列材料: (一)药品经营许可证申请表; (二)企业法人营业执照(可联网核查); (三)企业组织机构情况; (四)企业法定代表人、主要负责人、质量负责人、质量管理部门负责人学历证明复印件及个人简历; (五)执业药师或者药学技术人员资格证书(证明文件)及聘书或者任命文件; (六)拟经营药品的范围; (七)企业质量管理体系文件及陈列、仓储的设施设备目录; (八)拟设营业场所、设施设备、仓储地址及周边卫生环境等情况,仓库平面布置图及房屋产权或使用权证明。 申请企业应当对其申请材料全部内容的真实性负责。 第十二条 【许可证审查发证程序】药品监督管理部门按照以下程序审查核发《药品经营许可证》: (一)药品监督管理部门对申请人提出的申请,应当根据下列情况分别作出处理: 1.申请事项不属于本部门职权范围的,应当即时作出不予受理的决定,发给《不予受理通知书》,并告知申请人向有关部门申请; 2.申请材料存在可以当场更正错误的,应当允许申请人当场更正; 3.申请材料不齐或者不符合法定形式的,应当当场或者在5个工作日内发给申请人《补正材料通知书》,一次性告知需要补正的全部内容。逾期不告知的,自收到申请材料之日起即为受理; 4.申请事项属于本部门职权范围,材料齐全、符合法定形式,或者申请人按要求提交全部补正材料的,发给申请人《受理通知书》。《受理通知书》中注明的日期为受理日期。 (二)药品监督管理部门自受理申请之日起30个工作日内,对申报材料进行审查,并依据检查细则组织现场检查。 (三)现场检查结束后,药品监督管理部门应当将现场检查结果向社会公示,公示期不少于5个工作日。公示结束后,药品监督管理部门应当在10个工作日内作出审核结论。公示期内,如有投诉、举报的,药品监督管理部门应当组织调查核实,并根据调查核实结果,再作出审核结论。 经审核,符合条件的,予以批准,并自书面批准决定作出之日起5个工作日内核发《药品经营许可证》;不符合条件的,应当书面通知申请人并说明理由,同时告知申请人享有依法申请行政复议或提起行政诉讼的权利。 现场检查、调查核实、企业整改和检查结果公示的时间,不计入审批时限。 |
参考文献
[1] www.cfdi.org.cn/resource/news/11982.html
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57