新《药品管理法》自2019年12月1日起施行,2020年是新《药品管理法》实施后新监管时代的起步之年,新的一年新的开始,2019年度药品年度报告如何报?报什么?是当前药品上市许可持有人(MAH)最迫切关心的问题之一。
一、药品年度报告制度法律依据
2019年12月1日起施行的新《药品管理法》(2019年第31号主席令)第三十七条规定:药品上市许可持有人应当建立年度报告制度,每年将药品生产销售、上市后研究、风险管理等情况按照规定向省、自治区、直辖市人民政府药品监督管理部门报告;
2019年12月1日起施行的《**管理法》(2019年第30号主席令)第六十条规定:**上市许可持有人应当建立**质量回顾分析和风险报告制度,每年将**生产流通、上市后研究、风险管理等情况按照规定如实向国务院药品监督管理部门报告。
二、年度报告报告途径
新《药品管理法》(2019年第31号主席令)规定:持有人应当按照新修订《药品管理法》规定向省级局提交年度报告;
《**管理法》(2019年第30号主席令)规定:**持有人应当按照《中华人民共和国**管理法》规定向国家局提交年度报告。
据消息人士透露,国家药监局和各省级药监局正在调试药品年度报告报送和管理平台。
三、年度报告报告时间
根据目前疫情防控情况,笔者预测国家药监局近期即将出台《药品年度报告管理规定》,很可能要求药品上市许可持有人每年3月31日前编写年度报告并通过全国药品年度报告报送和管理平台完成上报。
四、企业如何建立年度报告制度
新《药品管理法》和《**管理法》规定了每年将药品生产销售、上市后研究、风险管理等情况按照规定向相关药品监督管理部门报告,笔者建议药品上市许可持有人应提前建立年度报告制度,结合参考FDA《Guidance for Industry CMC Postapproval Manufacturing Changes To Be Documented in Annual Reports》,内容建议至少包括以下几个方面:
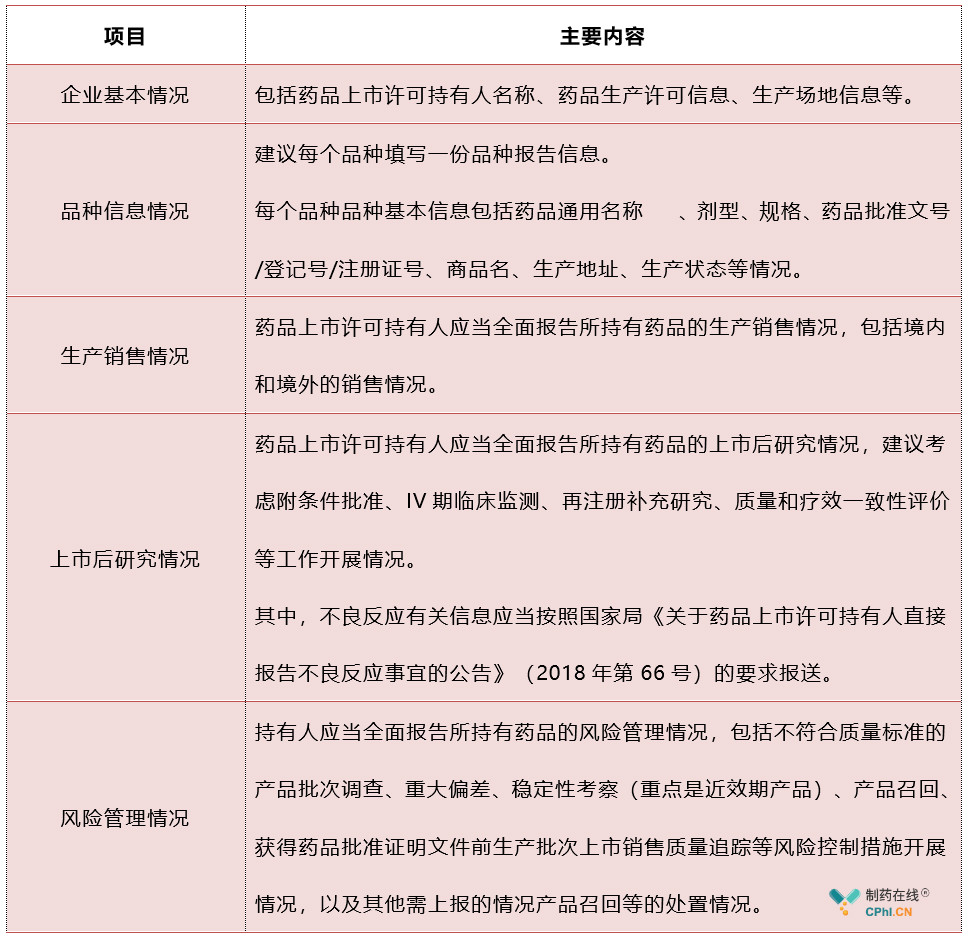
五、如何年度报告报告不及时,企业会承担哪些责任
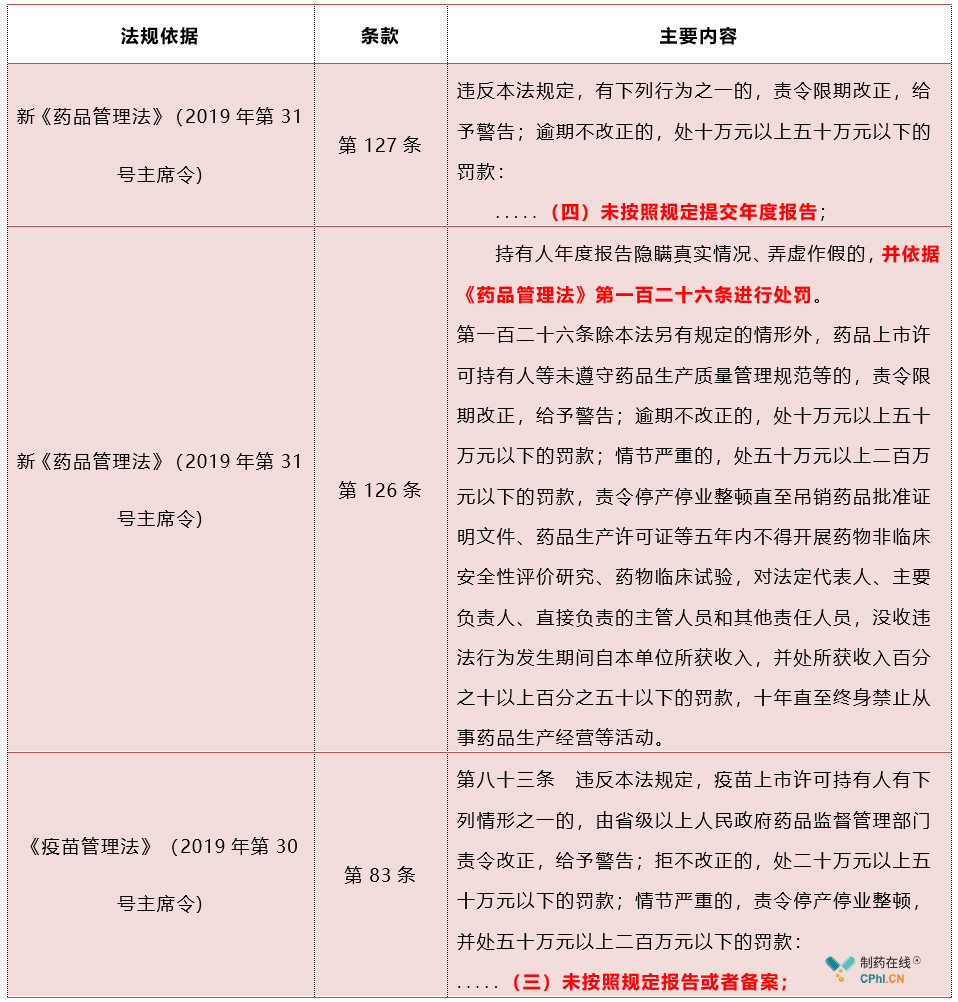
新《药品管理法》和《**管理法》实行年度报告制度对企业的监管将更加有效,增强了药品上市许可持有人向药品监督管理部门披露信息的主动性,也就增强了企业对社会负责的意识,促进企业自律和社会共治,维护良好的市场秩序,期望国家药监局年度报告制度具体内容以及报告程序建议监管部门的细则早日落地。
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。
点击下图进行CPhI & P-MEC China 2020观众预登记,立省100元观展门票!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57