
考虑到对已受理的药品上市注册申请确认MAH涉及到申请人的权益,2020年04月15日,国家药品监督管理局药品审评中心(CDE)官网发布《药审中心关于药品上市注册申请确认持有人有关事宜的通知》,明确了药品上市注册申请确认持有人有关事宜,本文对MAH药品上市注册申请相关热点问题进行了分析。
一、药品注册申请人如何成为MAH?
《药审中心关于药品上市注册申请确认持有人有关事宜的通知》提及药品注册申请人如何成为MAH两条原则:
(1) 原则一:只能有一个MAH
新修订的《药品管理法》实施前受理的注册申请,涉及两个或两个以上共同申请人的,在批准药品注册申请时应根据所有申请人签署同意的确认文件确定其中一个主体为该注册申请批准后的上市许可持有人。
(2) 原则二:不再受理两个共同申请人的注册
新修订的《药品管理法》实施后提出的药品注册申请,不再受理两个和两个以上主体共同作为上市注册申请人的上市注册申请,上市注册申请批准后,该注册申请人自然成为上市许可持有人。如已经受理的,按照第一条原则执行,意味着MAH不接受共同持有了。
二、申请药品上市同时申请成为MAH需要怎么做?
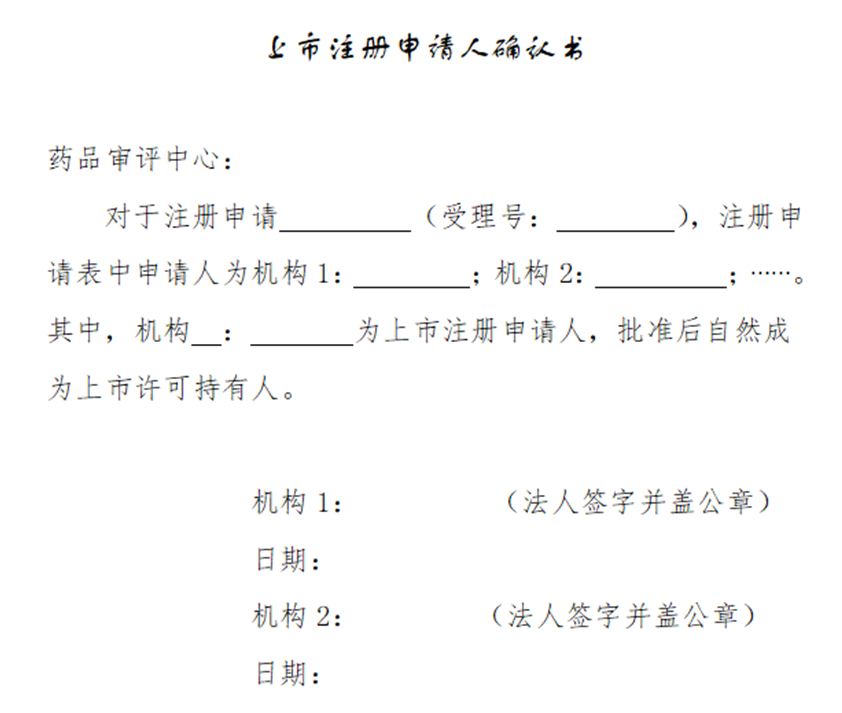
对已经受理上市注册申请,涉及两个或两个以上共同申请人的,申请人应尽快提交注册申请表中所有申请机构签署同意的《上市注册申请人确认书》(模板如下),最晚不得迟于该注册申请技术审评结束前提交。申请人应以邮寄方式提交一份纸质版,同时通过药审中心网站"申请人之窗"在相应注册申请的"问询式沟通交流"中电子提交彩色扫描版(pdf格式),并保证提交的纸质文本和电子文档内容一致。
三、药品说明书和标签注明MAH及地址,企业自主增加还是需要备案?
《药审中心关于药品上市注册申请确认持有人有关事宜的通知》提及,按照2019年12月1日起施行的新《药品管理法》(2019年第31号主席令第四十九条有关规定,标签或者说明书应当注明上市许可持有人及其地址。很多人就关注MAH是否需要向省局注册处提交标签说明书备案申请还是企业自主增加?这个问题自2019年12月1日起一直困扰着MAH,有些MAH向当地药监局咨询,答复是:等具体的实施细则下来之后再进行修订,现阶段还是执行24号令,不用增加,但有些药品经营企业且要求MAH的标签/说明书需要注明药品上市许可持有人及其地址,否则拒收。《广东省药品监督管理局办公室关于药品说明书和包装标签备案有关事宜的通知》这次给国内MAH提供了这个问题的解决思路,持有人应按照《药品管理法》第四十九条有关规定,在药品说明书或标签上注明持有人及其地址、生产企业及其地址等信息。如持有人与药品生产企业为同一主体的,由持有人自行修订药品说明书和标签的上述内容,无需向省药监局提交备案申请。
四、药品说明书和标签哪些情形可自行修改,MAH不用备案?
2020年3月13日,广东省药监局发布的《广东省药品监督管理局办公室关于药品说明书和包装标签备案有关事宜的通知》,终于明确了说明书,标签修改的方法,完成体现了"放管服"改革的监管理念,MAH是药品第一责任人的原则,对药品说明书和标签内容的准确性负责,如不符合规定的,由MAH自行承担相应法律责任,药品说明书和标签以下情形可自行修改,MAH自行修改药品说明书和标签,无需向省药监局提交备案申请:
1、已按照24号令要求完成药品说明书和标签备案核准后,根据国家药品标准颁布件及其修订批件等修改药品说明书的;
2、已按照24号令要求完成药品说明书和标签备案核准后,根据药品补充申请批件或备案公示内容等变更药品批准信息修改药品说明书的;
3、已按照24号令要求完成药品说明书和标签备案核准后,根据药品说明书内容修订标签的。
4、已按照24号令要求完成药品说明书和标签备案核准后,对《药品注册管理办法》及国家药监局相关文件中均未要求备案的内容进行修改的,由持有人按24号令及其相关规定自行修改药品说明书和标签,无需向省药监局提交备案申请,如电话号码、企业网址、电子监管码、条形码、颜色、图案、注册商标等内容修改。
参考文献
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=315037
[2] mpa.gd.gov.cn/xwdt/tzgg/content
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。
点击下图进行CPhI & P-MEC China 2020观众预登记!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57