2020年5月15日,国家药品监督管理局药品审评中心官网发布了广受社会各界关注的《药品说明书和标签管理规定》(征求意见稿),会稿截止日期2020年6月15日,新版《药品说明书和标签管理规定》共七章40条,体现了"四个最严"**,为贯彻落实《药品管理法》和《药品注册管理办法》有关要求,进一步加强药品说明书和标签的全生命周期动态管理,构建药品说明书和标签统一管理体系,本文对新旧版《药品说明书和标签管理规定》主要新增修订内容进行了对比分析。
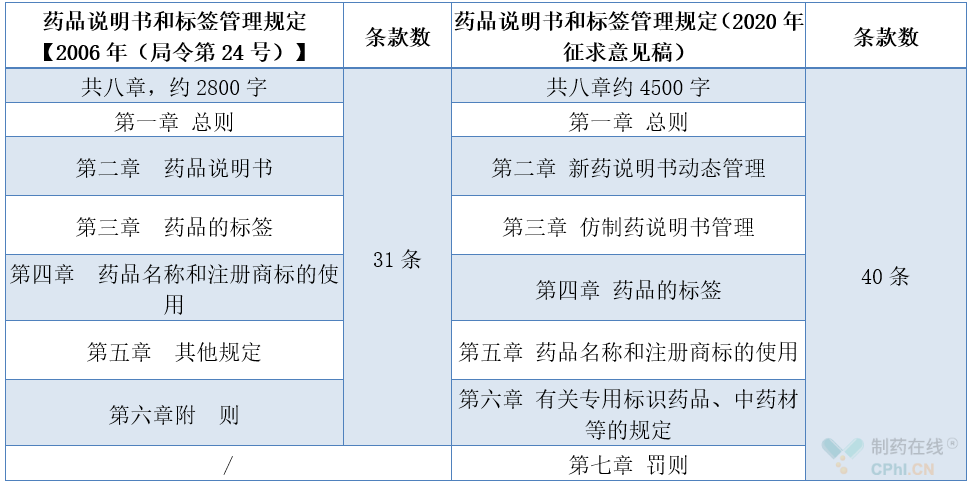
一、新旧版《药品说明书和标签管理规定》章节对照表
新版《药品说明书和标签管理规定》共七章40条,新增了15条款,修订了8条款,删除了3条款,17条款保持不变。增加了按假劣药罚则、强化持有人是药品说明书和标签的责任主体,负责药品说明书和标签的制定、修订和维护。
二、增修订内容分析
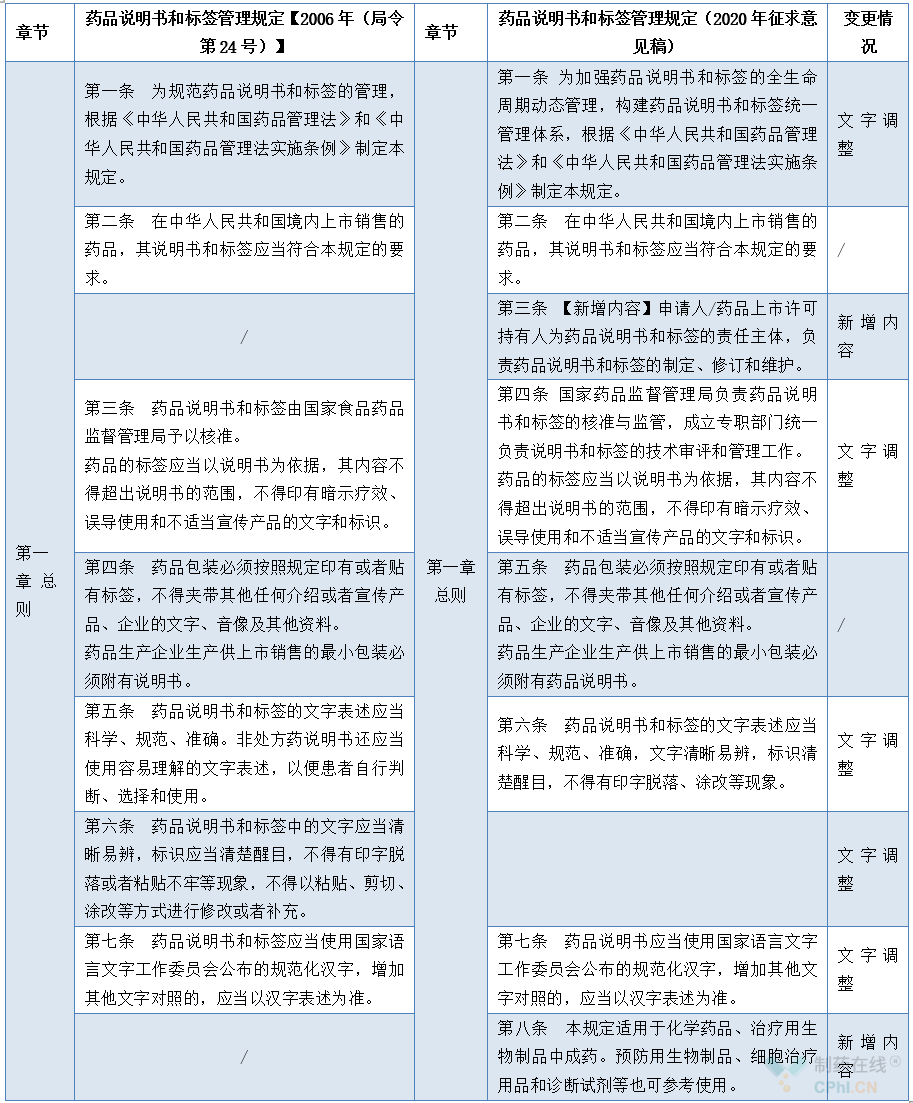
2.1 第一章 总则增修订内容对照表
2.2 第二章 新药说明书动态管理增修订内容对照表

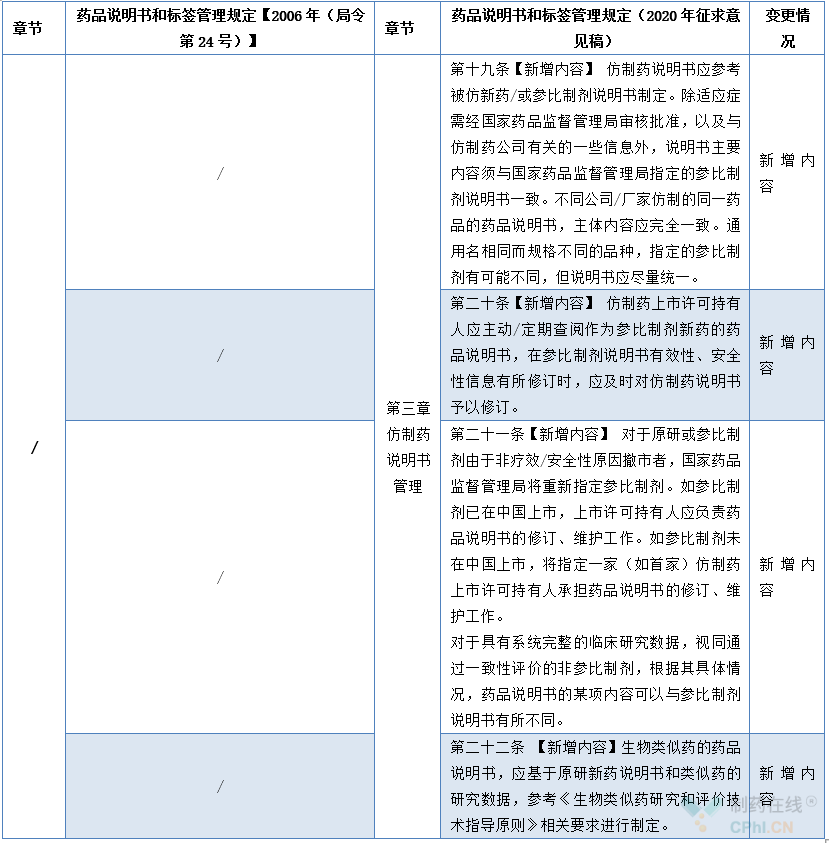
2.3 第三章 仿制药说明书管理增修订内容对照表
2.4 第四章 药品的标签增修订内容对照表

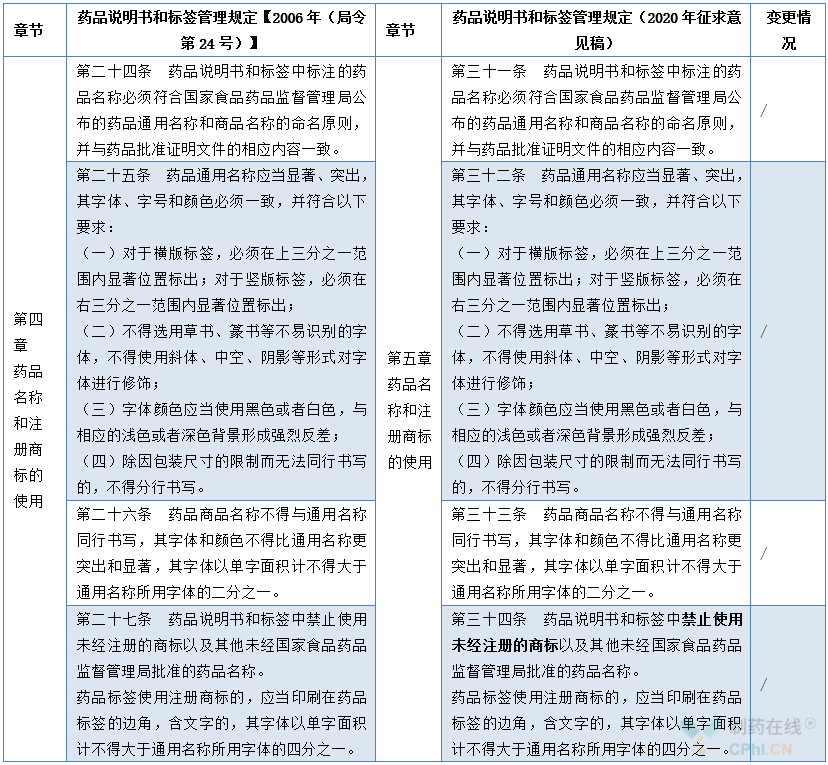
2.5 第五章 药品名称和注册商标的使用增修订内容对照表
2.6 第六章 有关专用标识药品、中药材等的规定增修订内容对照表

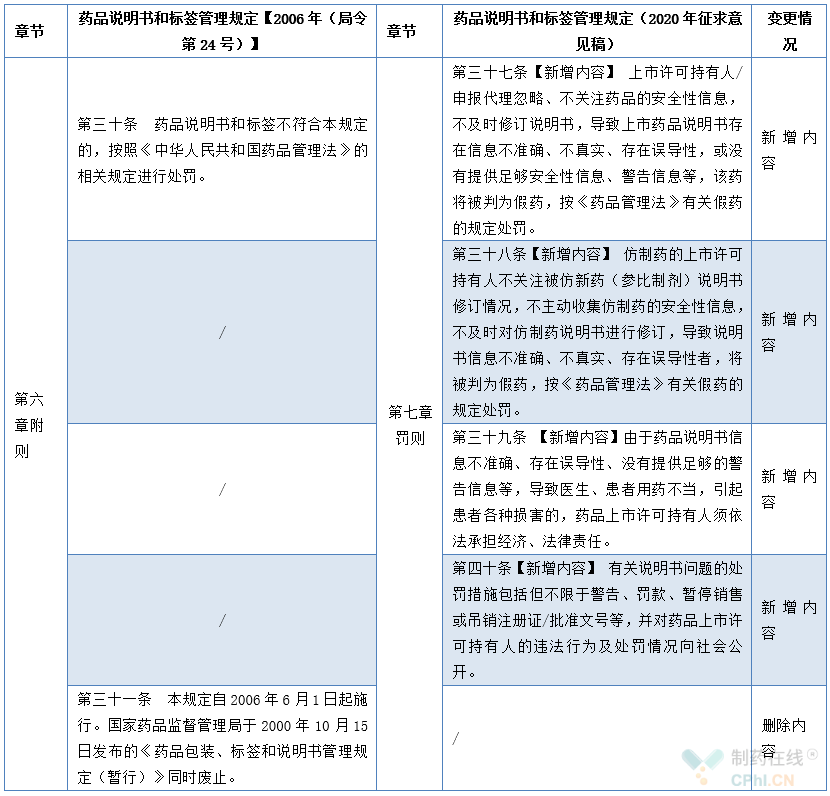
2.7 第八章 罚则增修订内容对照表
参考文献:
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=315076l
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57