为贯彻落实《中华人民共和国药品管理法》《中华人民共和国**管理法》等法律法规,2020年10月13日,国家药监局官网发布了新版《药品召回管理制度》(征求意见稿),征求意见截止日期:2020年10月30日,新版《药品召回管理制度》共五章31条,本文对新旧版《药品召回管理制度》主要新增修订内容进行了对比分析。
一、解析新修订版《药品召回管理制度》基本框架结构变化
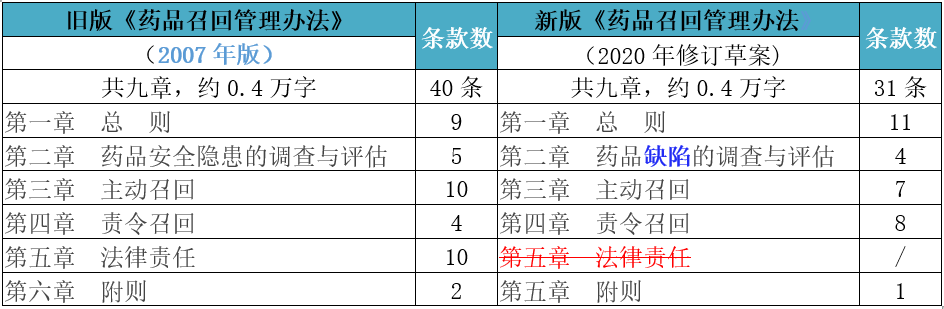
新版《药品召回管理制度》基本框架结构包括总则,药品缺陷的调查与评估,主动召回,责令召回,附则共五章31条,与旧版(2007年版,为2007年12月10日发布并实施)相比,条款总数减少了9条,第二章节将原"药品安全隐患的调查与评估"修改为"药品缺陷的调查与评估";原第五章法律责任全部删除;字数都在四千个字左右,建立了新药法时代比较完善的药品召回管理制度。
二、新旧版《药品召回管理制度》内容变化对照看
新版《药品召回管理制度》修订的亮点包括但不仅限于:重新定义了召回的含义和范围;将"药品生产企业"修改为"药品上市许可持有人";删除了"包括进口药品的境外制药厂商,将"已上市销售的存在安全隐患的药品"修改为"已上市存在缺陷的药品",并增加了"并采取相应措施,控制消除缺陷的活动";将"安全隐患"修改为"缺陷药品",增加了"销售、储运、标识",将"可能使药品具有的危及人体健康和生命安全的不合理危险"修改为"导致存在质量问题或者其他安全隐患的药品";征求意见稿通过"缺陷药品"扩大了召回的范围;删除了"法律责任"一章内容;明确药品上市许可持有人应当将药品召回的情况在药品年度报告中提交等,新旧版《药品召回管理制度》内容变化对照如下表所示,文章内容蓝色字体为新增或修改的内容,红色字体的含删除线的为已删除的内容:

参考文献
[1] www.nmpa.gov.cn/xxgk/zhqyj/zhqyjyp/20201013104036103.html
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57