2021年01月08日(星期五),中国医药包装协会官网发布公开征求《药包材等同性/可替代性评价指南》(征求意见稿)的通知,征求意见截止日期2021年02月09日,这是国内专门针对药包材等同性/可替代性评价起草的指导性文件,本文为大家梳理了药包材变更难点和等同性评价实施关键点,可供药包材企业提供变更研究的基础研究思路和基本评估原则,也可为药企开展药包材变更评估提供参考。
一、药包材变更管理的难点
药包材是指采用相同或相似的生产工艺和材料,具有相同或相似功能的产品,包括不同的型号和规格,是药品不可缺少的组成部分,它伴随着药品的生产、流通和使用全过程,因此药包材对于保证药品的安全性、有效性起着重要的作用,近年来,随着我国药品改革,药包材的相应监管模式也在发生着巨大变化,我国药包材监管模式从"注册管理制度"改革为"关联审评审批制度",在药包材关联审评审批制度中,药品上市许可持有人是产品质量第一责任人。但这并不意味着药包材生产企业的责任变轻了,在配合药品上市许可持有人研究、提高产品质量方面,药包材生产企业的角色不容缺位。关联审评审批制度给药品上市许可持有人和药包材生产企业提供了合作和技术交流的机会,从而更好地确保药品质量和用药安全,在这个过程中,包材企业同样要对制剂企业负责,管控好药包材的变更,与制剂企业一道采取科学的评估手段,避免药包材的变更给药物带来不良影响,我国目前药包材企业小而散乱,质量意识不足,各地包材企业能力不一,而各地监管也存在尺度的偏差。因此需要中国医药包装协会等组织推出与共同审评制度相关的配套法规、标准与技术指导文件,比如出台《药包材等同性/可替代性评价指南》等。
二、药包材变更等同性评价实施关键点
2.1 适用范围

2.2 药包材的等同评价与判定原则
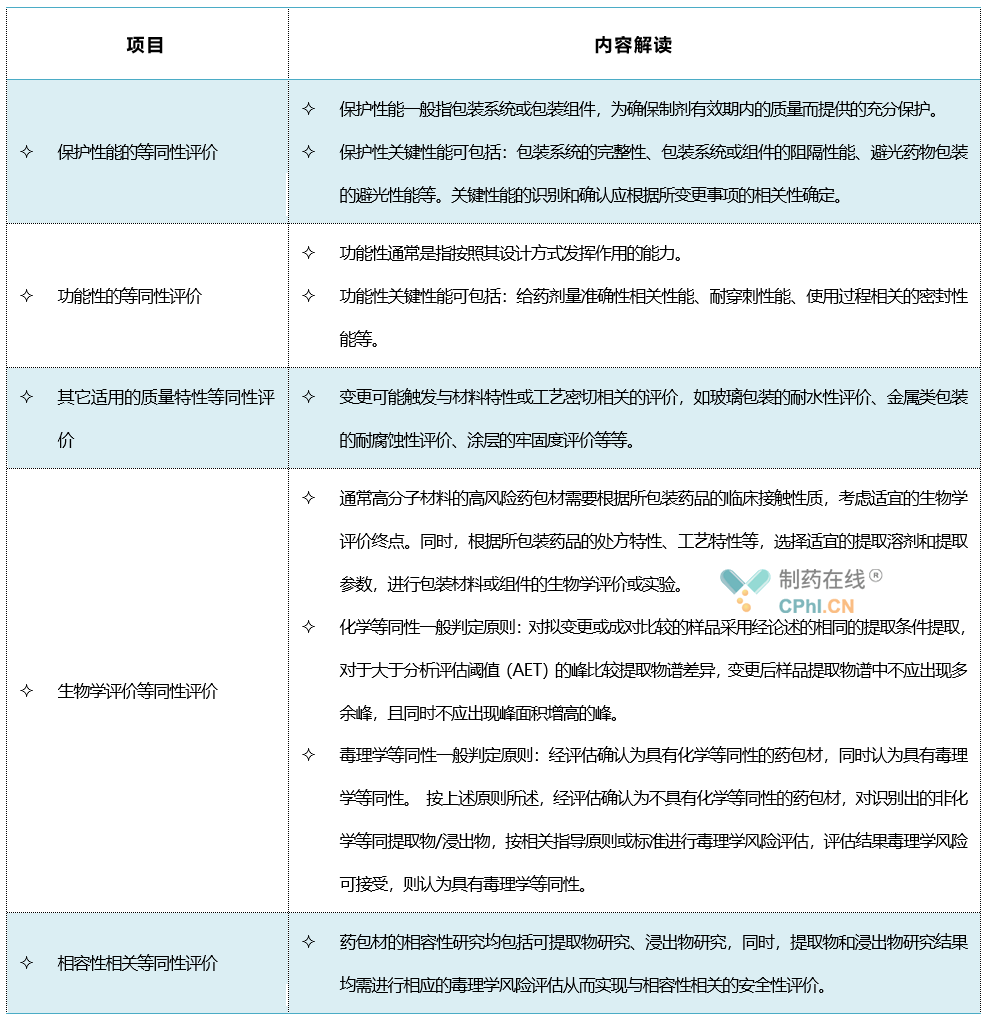
药包材等同性是指已上市药品发生包装材料和容器的变更或药包材生产企业在生产制造过程中发生技术类变更时,变更前后的药包材的质量属性一致性,即风险可接受程度一致性。药包材的质量属性包括安全性、保护性、功能性、相容性,即药包材的适用性。药包材的等同性评价做为一种技术工具,应用于通过风险识别和/或相关法规性文件所确认的研究验证。这些研究验证,适用时,一般包括如上所述的药包材保护性关键性能的等同性评价、功能性关键性能的等同性评价、其它适用的质量特性等同性评价、生物学评价等同性评价、相容性相关等同性评价等。
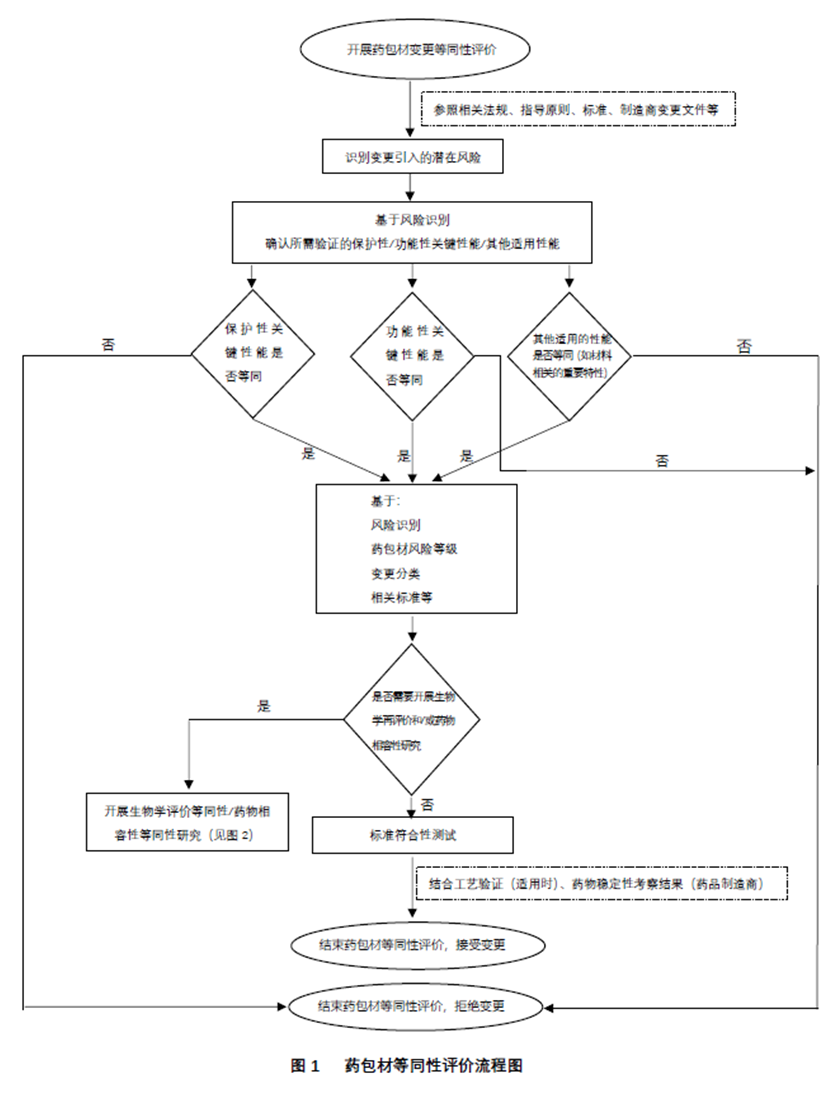
2.3 药包材等同性评价流程
药包材等同性评价是基于风险管理理念,为减少不必要的实验,对已上市药品包装材料和容器的变更或药包材的技术类变更所进行的评价。药包材等同性评价方案宜首先考虑相关法规性文件、技术指南/指导原则、标准等要求。其次,根据风险管理理念,采用相关风险管理标准和工具,经风险评估所形成的制造商内部变更管理文件也是等同性研究的重要参考。药包材等同性评价参考的流程图如下:
参考文献
[1] www.cnppa.org
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57