2021年2月18日,牛年春节后第一个工作日,国家药品监督管理局药品审评中心官网发布《生物类似药相似性评价和适应症外推技术指导原则》(成文时间2021年2月10日),自发布之日2021年2月18日起实施,此指南为进一步规范和指导生物类似药研发和评价,为工业界、研究者及监管机构提供技术参考,目前,我国尚未有专门的生物类似药相似性评价和适应症外推技术技术指导原则,该指导原则的正式实施将助力国内生物类似药质量的进一步提升,本文为大家梳理了本指导原则中生物类似药相似性评价和适应症外推重点内容并结合自己的解读与大家分享。
一、为何叫"生物类似药",而不叫"生物仿制药"?
近年来,生物类似药依然是国内外制药界的明星药物,中国许多非生物类制药公司大举进军生物类似药市场,据报道全球在研生物类似药数量最多的国家是中国,那么到底何为生物类似药?而对于生物类似药(biosimilar)的定义,各国并无统一的、标准的定义和看法。2015年3月,CFDA在其发布的《生物类似药研发与评价技术指导原则(试行)》文件中首次将biosimilar称为生物类似药,是指:在质量、安全性和有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。在2019年2月批准首 个生物类似药(复宏汉霖公司的利妥昔单抗注射液);在2020年的新版《药品注册管理办法》才确认生物类似药的分类。这是由于相比于化学仿制药(generics),生物类似药和化学仿制药的核心区别是生物类似药只能和原研生物药类似,而不可能完全一样。另外,从国际上看,对生物类似药的定义主要来自如下三个最为重要和有影响力的机构组织。
第一:世卫组织(WHO): "A biotherapeutic product which is similar in terms of quality, safety and efficacy to an already licensed reference biotherapeutic product"。和一种已经批准的参比生物治疗产品在质量、安全性和效力方面均相似的生物治疗产品。
第二:欧盟EMA: "A biological medicine that is developed to be similar to an existing biological medicine (the 'reference medicine'). When approved, a biosimilar's variability and any differences between it and its reference medicine will have been shown not to affect safety or effectiveness. "。与已经存在的生物药(即:参比药)类似的生物药。在批准时,该生物类似药自身的可变性以及与参考药的任何不同之处均应被证明不影响仿制药的安全性和有效性。
第三:美国FDA: "A biological product that is highly similar to a U.S. licensed reference biological product notwithstanding minor differences in clinically inactive components, and for which there are no clinically meaningful differences between the biological product and the reference product in terms of the safety, purity and potency of the product". 与一种美国批准的参考生物产品高度相似,尽管无活性组分有小的差异;在临床上和参考生物产品相比在安全性、纯度与效力方面没有显著差异。
尽管上述三种定义不尽相同,但是大同小异,并且都强调了生物类似药的安全性的重要性,而这个安全性主要是指病人或健康受试者身上的临床安全表现,这也决定了生物类似药必须要有临床实验来证明与参比原研生物药相比有相似的安全性,这也是生物类似药和化学仿制药一大不同,另外生物药通常分子量通常大于5000,由多个氨基酸序列组成,如果要求"仿制"得完全一样,不仅氨基酸序列一级结构相同,还要求高级结构(二级/三级/四级)相同,甚至糖基化修饰等也相同,这简直就是一个不可完成的任务。所以,为了保持严谨,没有用"生物仿制药",而使用"生物类似药"的概念。
二、CDE对生物类似药相似性评价和适应症外推判定要求
为进一步规范和指导生物类似药研发和评价,为工业界、研究者及监管机构提供技术参考,CDE制定发布了《生物类似药相似性评价和适应症外推技术指导原则》。
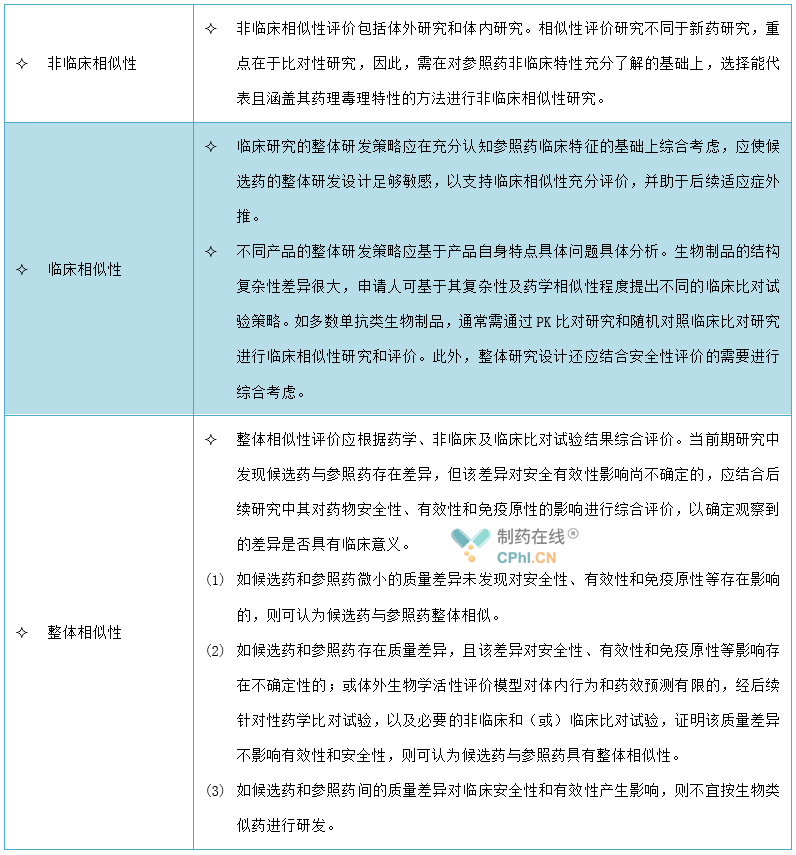
1、相似性评价

2、适应症外推

参考文献
[1] www.cde.org.cn
[2] www.glyibao.cn/71099
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57