2021年是中国共产党成立100周年,是"十四五"规划的开局之年,也是药品上市后监管新起点,2021年离药监局要求药品上市许可持有人每年3月31日前上报药品年度报告的时限(**年报另有规定),时间余额不多了,还未准备的企业要抓紧了,本文为大家梳理了2020年12月10日国家药品监督管理局发布《药品年度报告管理规定》(征求意见稿)中关于年度报告撰写主要内容并结合自己的解读与大家分享,如有不妥,恳请大家提出宝贵意见。
一、什么是药品年度报告?
药品年度报告是指持有人按自然年度收集所持有药品的生产销售、上市后研究、风险管理等方面的信息,进行汇总和统计所形成的报告;药品年度报告是MAH的固有的责任和义务,报告药品全生命周期管理的主要内容,是药品上市后管理的重要一环。新发布实施的《药品管理法》和两办法(《药品生产监督管理办法》、《药品注册管理办法》)都提到年度报告制度相关内容,梳理如下:
(1) 2019年12月1日起施行的新《药品管理法》(2019年第31号主席令)第三十七条规定:药品上市许可持有人应当建立年度报告制度,每年将药品生产销售、上市后研究、风险管理等情况按照规定向省、自治区、直辖市人民政府药品监督管理部门报告;
(2) 2020年7月1日起施行的新《药品生产监督管理办法》第三十九条规定:药品上市许可持有人应当建立年度报告制度,按照国家药品监督管理局规定每年向省、自治区、直辖市药品监督管理部门报告药品生产销售、上市后研究、风险管理等情况。
(3) 2020年7月1日起施行的新《药品注册管理办法》第八十条 以下变更,持有人应当在年度报告中报告:(一)药品生产过程中的微小变更;(二)国家药品监督管理局规定需要报告的其他变更。
二、药品年度报告如何报?
新《药品管理法》规定:MAH应当按照新修订《药品管理法》规定向省级局提交年度报告;《药品年度报告管理规定》要求MAH应当按照本规定要求收集汇总上一个自然年度的药品年度报告信息,于每年3月31日前通过年度报告信息系统进行报告,3月31日前可以对已经提交的报告自行更正;超过时限后不得修改,发现不符合要求的,持有人应当承担相应责任。表明国家药监局和各省级药监局正在搭建年度报告信息系统。如是当年获批上市的药品,持有人自下一年度起实施报告。
三、药品年度报告包含哪些内容?
新《药品管理法》规定了每年将药品生产销售、上市后研究、风险管理等情况按照规定向相关药品监督管理部门报告,笔者建议药品MAH提前参考《药品年度报告管理规定》修订本企业的药品年度报告制度,内容建议至少包括以下几个方面:
(一)基本信息
包括持有人信息、生产许可信息、生产地址信息和报告信息,举例如下:
1) 报告周期:2020年01月01日-2020年12月31日
2) 药品上市许可持有人报告信息
♦ 药品上市许可持有人名称:****
♦ 药品生产许可证编号:****
♦ 统一社会信用代码:****
♦ 生产地址信息:****
年度报告信息系统填报是注意事项:
(1) 报告周期为上一自然年度的1月1日至12月31日。
(2) 每个品种填写一份品种报告信息,该品种有多个制剂规格的(药品批准文号/注册证号),只填写一份品种报告;长期停产的药品或者本年度未生产销售的药品也应当按照要求每年上报;核发批准文号的中药饮片品种和中药饮片分别按要求进行报告。
(二)品种信息
建议包括产品基本情况、产品生产销售情况、上市后研究、风险管理情况等。
(1) 产品基本情况:
表1:(适用于中成药、化学药、生物制品、**生产企业或上市持有人填报)
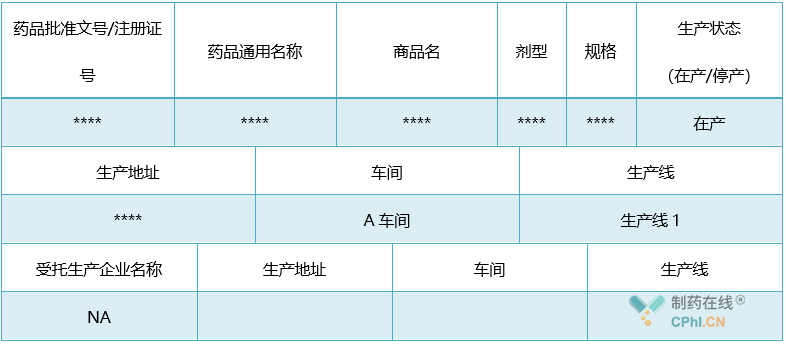
年度报告信息系统填报注意事项:生产状态为该品种在上报年度内"生产"或"未生产",阶段性生产的按"生产"填报;一个品种有多个生产地址或多个受托生产企业的应分别列明;中药饮片根据产品特性的实际情况填写表格中的相关信息,不适用的项目填写"N/A"。
(2) 产品生产销售情况:
2.1产品生产销售情况(境内)
表2:(适用于中成药、化学药、生物制品、**生产企业或上市持有人填报)

2.2产品生产销售情况(境外)
表3:(适用于中成药、化学药、生物制品、**生产企业或上市持有人填报)

年度报告信息系统填报注意事项:按出口国填写,生产数量、销售数量分别为该品种上报年度内的所有生产地址所生产、销售的总数量;数量单位以"万支/万瓶/万片/万粒/万袋…"计;如该药品属于基本药物、OTC、短缺药品、通过一致性评价药品、国家集采药品、儿童药品等情形的,需在备注中全部注明。
(3) 上市后研究情况:
表4:(适用于中成药、化学药、生物制品、**生产企业或上市持有人填报)
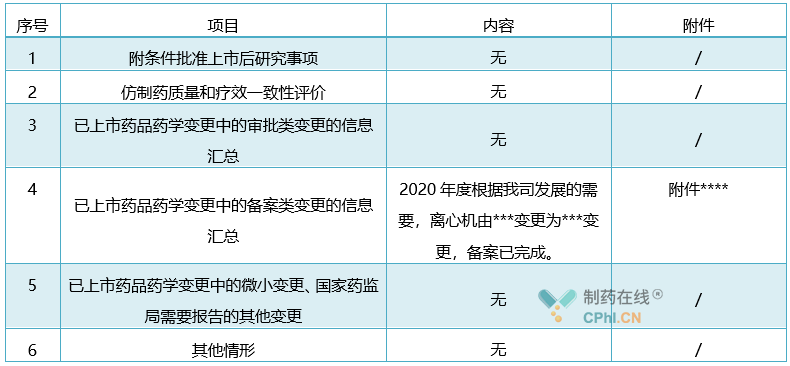
年度报告信息系统填报注意事项:
► 附条件批准上市后研究:附条件批准药品上市后,按照《药品注册批件》附件所附条件以及持有人承诺,需继续完成的工作。所有有关临床安全性、有效性、临床药理和非临床毒理学的药品上市后研究的进度报告简述。
► 仿制药质量和疗效一致性评价:持有人简述该品种的仿制药质量和疗效一致性评价开展进度情况,已通过仿制药质量和疗效一致性评价品种同时上传批准证明文件。
► 已上市药品药学变更中的微小变更:持有人按照已上市药品变更相关技术指导原则界定的微小变更进行报告。
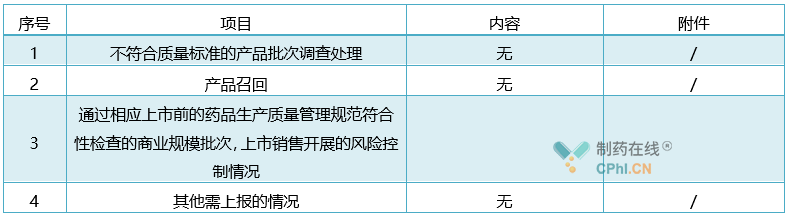
(4) 风险管理情况:
表5:(适用于中成药、化学药、生物制品、**生产企业或上市持有人填报)
四、国外委托加工产品信息(如有)
表6:国外委托加工产品信息
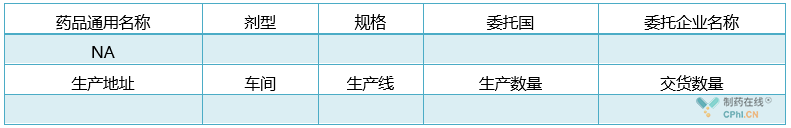
注:按生产线填写
五、报告不规范,会怎么罚?
【违法情形1】持有人未按照规定提交年度报告的,依照《药品管理法》第127条给予警告,责令其20个工作日内改正;逾期不改正的,处十万元以上五十万元以下的罚款。
【处罚依据】《药品年度报告管理规定》(征求意见稿)第16条。
【违法情形2】未按照规定提交年度报告,责令限期改正,给予警告;逾期不改正的,处十万元以上五十万元以下的罚款:
【处罚依据】新《药品管理法》第127条。
【违法情形3】持有人年度报告隐瞒真实情况、弄虚作假的,责令限期改正,给予警告;逾期不改正的,处十万元以上五十万元以下的罚款;情节严重的,处五十万元以上二百万元以下的罚款,责令停产停业整顿直至吊销药品批准证明文件、药品生产许可证等五年内不得开展药物非临床安全性评价研究、药物临床试验,对法定代表人、主要负责人、直接负责的主管人员和其他责任人员,没收违法行为发生期间自本单位所获收入,并处所获收入百分之十以上百分之五十以下的罚款,十年直至终身禁止从事药品生产经营等活动。
【处罚依据】新《药品管理法》第126条。
参考文献
[1] www.NMPA.org.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57