
基因治疗产品的良好疗效,被业界人士人为将引领生物医药的第三次产业革命。2021年6月4日,国家药品监督管理局药品审评中心官网发布《基因治疗产品长期随访临床研究技术指导原则(征求意见稿)》,截止日期至2021年7月4日。此指南为本指导原则针对基因治疗长期随访临床研究的观察方法和研究设计进行讨论,着重阐述了基因治疗长期随访临床研究的观察目的、考虑要素、设计实施以及不同基因治疗产品的特殊考虑等相关要求。目前,美国FDA和欧盟EMA均已发布相关技术指导原则,而国内尚无相关指导原则对基因治疗产品长期随访临床试验设计进行规范指导,本文为大家梳理了本指导原则中基因治疗产品长期随访临床研究内容并结合自己的解读与大家分享。
一、为何制定基因治疗产品长期随访专门指南?
基因治疗:是指通过修饰或操纵基因的表达或改变活细胞的生物学特性以达到治疗目的的治疗手段,主要作用机制有正常基因替换致病基因、使不能正常工作的基因失活或者引入新的或修饰的基因等方式。活细胞的生物学特性这些变化在体内长期存在,可能增加不可预测的风险。为了评估和降低这类风险,并了解治疗效果随时间延长的变化,有必要对参加基因治疗临床试验的受试者开展长期随访。
基因治疗产品长期随访的主要目的是收集受试者的迟发性不良反应,了解基因治疗产品在体内的存续情况,从而识别并降低接受基因治疗产品的患者的长期风险。此外,考虑到基因治疗产品长期作用的特点,观察疗效随时间的变化情况也是长期随访的重要目的。目前,美国FDA和欧盟EMA均已发布相关技术指导原则,经查询,欧盟EMA于2010年发布的《有关基因治疗产品给药后患者随访的指南(Guideline on follow-up of patients administered with gene therapy medicinal products)》指南;美国FDA于2020年1月发布的《人类基因治疗产品给药后的长期随访(Long-term Follow-up After Administration of Human Gene Therapy Products)》指南,考虑到国内尚无相关指导原则对基因治疗产品长期随访临床试验设计进行规范指导,CDE在充分调研国内外同品种研发情况以及相关临床试验技术要求基础上,起草了《基因治疗产品长期随访临床研究技术指导原则(征求意见稿)》。
二、基因治疗产品长期随访观察时间梳理
长期随访的持续时间应确保足以观察到受试者因产品特性、暴露情况(生物分布和给药途径)等导致的风险,应不短于迟发性不良反应的预期发生时间。具体产品的随访时间取决于产品的特性和体内存在时间、转基因表达时间、迟发性不良反应的预期时间及发生率、受试者适应症和预期生存期、给药途径、以及长期随访的其他观察目的。随着随访数据的积累,研究者和研究申办方可能会根据产品的存在情况、转基因表达和临床表现的持续评估情况,延长或缩短长期随访的持续时间。一般而言,针对不同类型的基因治疗产品长期随访观察时间建议如下表:
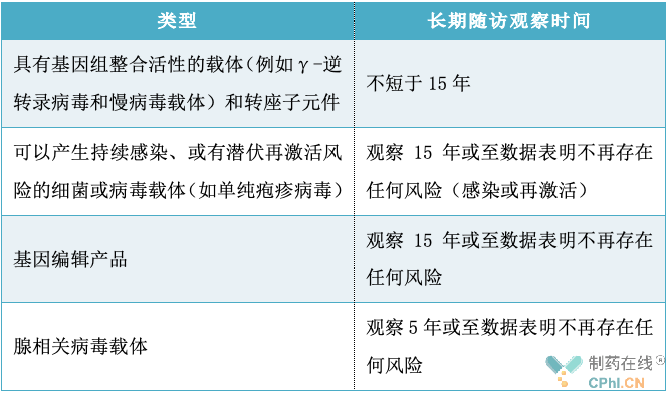
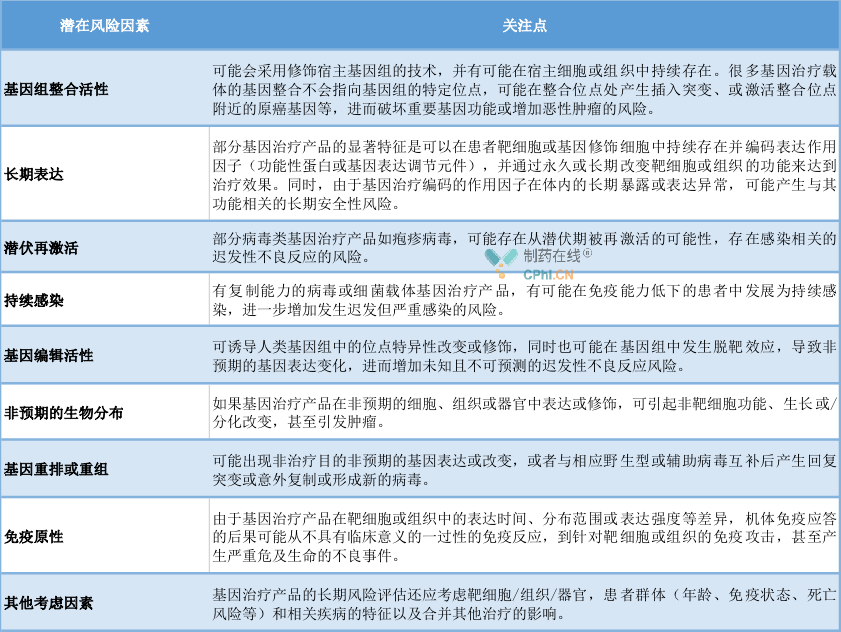
三、基因治疗产品长期随访风险评估策略
当前基因治疗产品的发展势头强劲,据报道全球正在进行的基因治疗临床试验超过2000项。但它也会对人体带来长期或永 久性影响,接受基因治疗的患者出现迟发性不良反应的风险可能会增加,识别并降低接受基因治疗产品的患者的长期风险,受试者可能需要接受长期随访,长期随访观察中迟发性不良反应相关的潜在风险因素包括但不限于以下几个要素:
参考文献
[1] http://www.cde.org.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57