2021年10月20日,国家药品监督管理局官网发布了关于公开征求《已上市中药说明书安全信息项内容修订技术指导原则(征求意见稿)》意见的通知,会稿截止日期2021年11月20日,广受医药各界关注,本文已上市中药说明书安全信息项内容主要新增修订内容进行了分析。
一、已上市中药说明书撰写政策
药品说明书是医师、药师和患者了解和使用药品的科学依据,对指导临床用药具有重要作用,部分中药虽已上市多年,但其说明书安全信息项内容仍存在信息不规范、不完整的问题(安全的项下写着“尚不明确”、“不详“等),给患者和医师造成困惑,影响安全合理用药,亟需修订。笔者初步梳理了一下,为规范中药说明书的书写和印制,国家药监部门陆续颁布了《药品说明书和标签管理规定》(国家食品药品监督管理局令第24号,2006年6月1日起施行)、《中成药非处方药说明书规范细则》(2006年10月20日起施行)、《中药、天然药物处方药说明书格式》(2007年7月1日起施行)、《中药、天然药物处方药说明书内容书写要求》(2007年7月1日起施行)、《中药、天然药物处方药说明书撰写指导原则》(2007年7月1日起施行)、《中药处方药说明书通用格式和撰写指南(征求意见稿)》(征求意见时间2020年7月6日至2020年7月20日)。
二、已上市中药说明书格式
(1)中成药非处方药说明书格式(示例)
非处方药、外用药品标识位置
X X X说明书
请仔细阅读说明书并按说明使用或在药师指导下购买和使用
警示语位置
【药品名称】
【成份】
【性状】
【功能主治】
【规格】
【用法用量】
【不良反应】
【禁忌】
【注意事项】
【药物相互作用】
【贮藏】
【包装】
【有效期】
【执行标准】
【批准文号】
【说明书修订日期】
【生产企业】
如有问题可与生产企业联系
(2)中药、天然药物处方药说明书格式(示例)
核准日期和修改日期
特殊药品、外用药品标识位置
X X X说明书
请仔细阅读说明书并在医师指导下使用
警示语
【药品名称】
通用名称:
汉语拼音:
【成份】
【性状】
【功能主治】/【适应症】
【规格】
【用法用量】
【不良反应】
【禁忌】
【注意事项】
【孕妇及哺乳期妇女用药】
【儿童用药】
【老年用药】
【药物相互作用】
【临床试验】
【药理毒理】
【药代动力学】
【贮藏】
【包装】
【有效期】
【执行标准】
【批准文号】
【生产企业】
企业名称:
生产地址:
邮政编码:
电话号码:
传真号码:
注册地址:
网 址:
三、中药说明书安全信息项修订内容解读
近年来,中医药逐渐被国际认可,中药说明书安全信息项目是指能够直接反映药品的安全性与合理用药措施的相关项目,主要包括警示语、不良反应、禁忌、注意事项、特殊人群用药项目。目前,已上市中成药说明书中这些不少标注为“尚不明确”、“不详“等,表述不够全面。中药是国宝,又关系老百姓的生命健康问题,《已上市中药说明书安全信息项内容修订技术指导原则》的制定,及将来的落地实施意义重大,不仅能够指导中药MAH修订说明书,建立标准化技术流程,而且填补了行业空白,有助于推动药学服务与学术进展,更好满足全民健康需求”。规范化将倒逼中药高质量发展,有利于中药走向世界。本次修订细则部分主要涉及说明书的警示语、不良反应、禁忌、注意事项、特殊人群用药等5项安全信息项内容,主要修订内容如下:
1、【警示语】
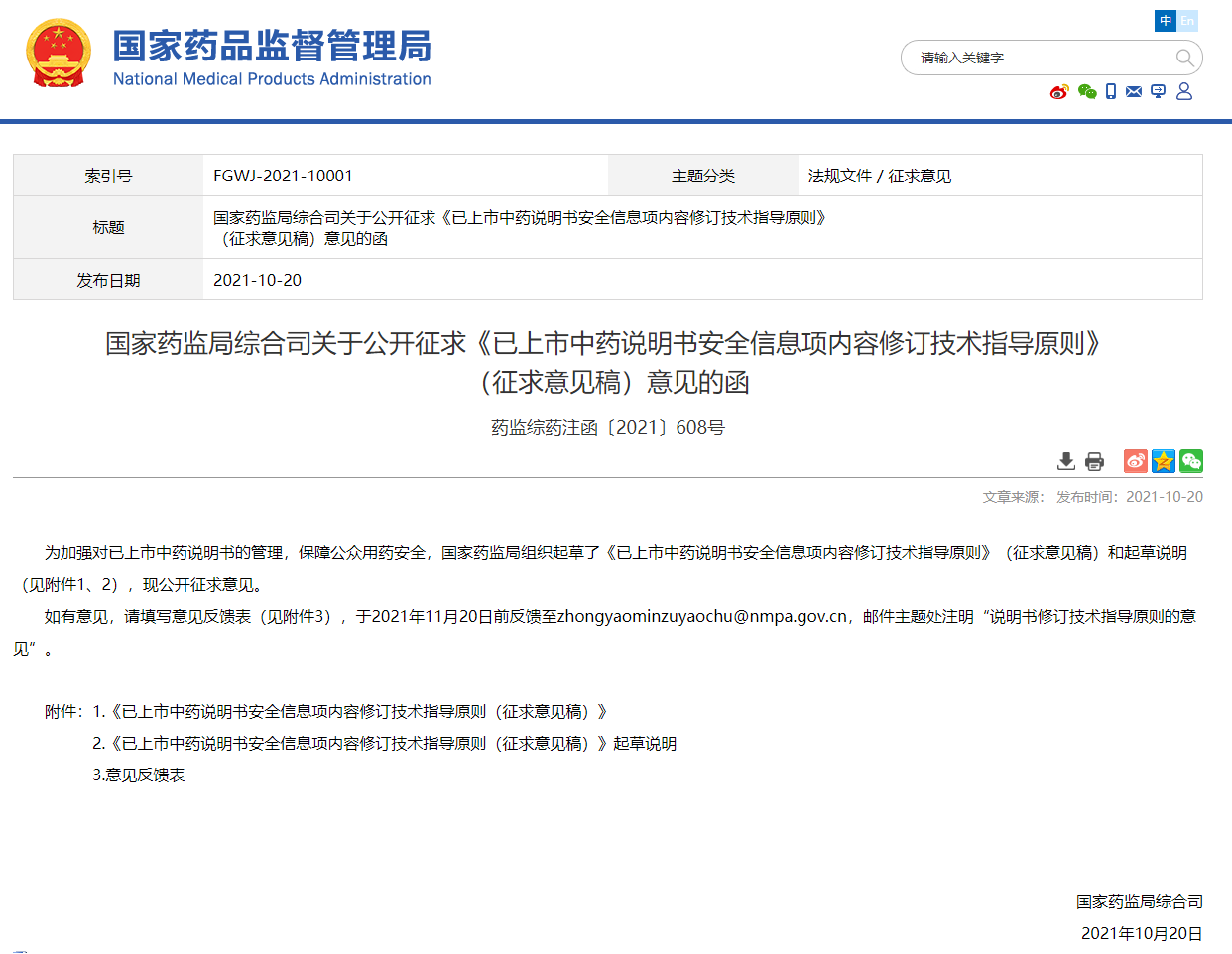
当发现已上市中药存在严重不良反应或潜在的重要安全性问题而需要警示用药时,才在中药说明书标题下添加警示语。在判断是否需要添加警示语时,需要具体问题具体分析,避免泛化警示语的使用。本技术指导原则列出了警示语的常见情形,供修订说明书时参考,具体采用其中的一种,还是需要若干种同时警示,应当视品种情况而定。 【警示语】示例如下:
2、【不良反应】
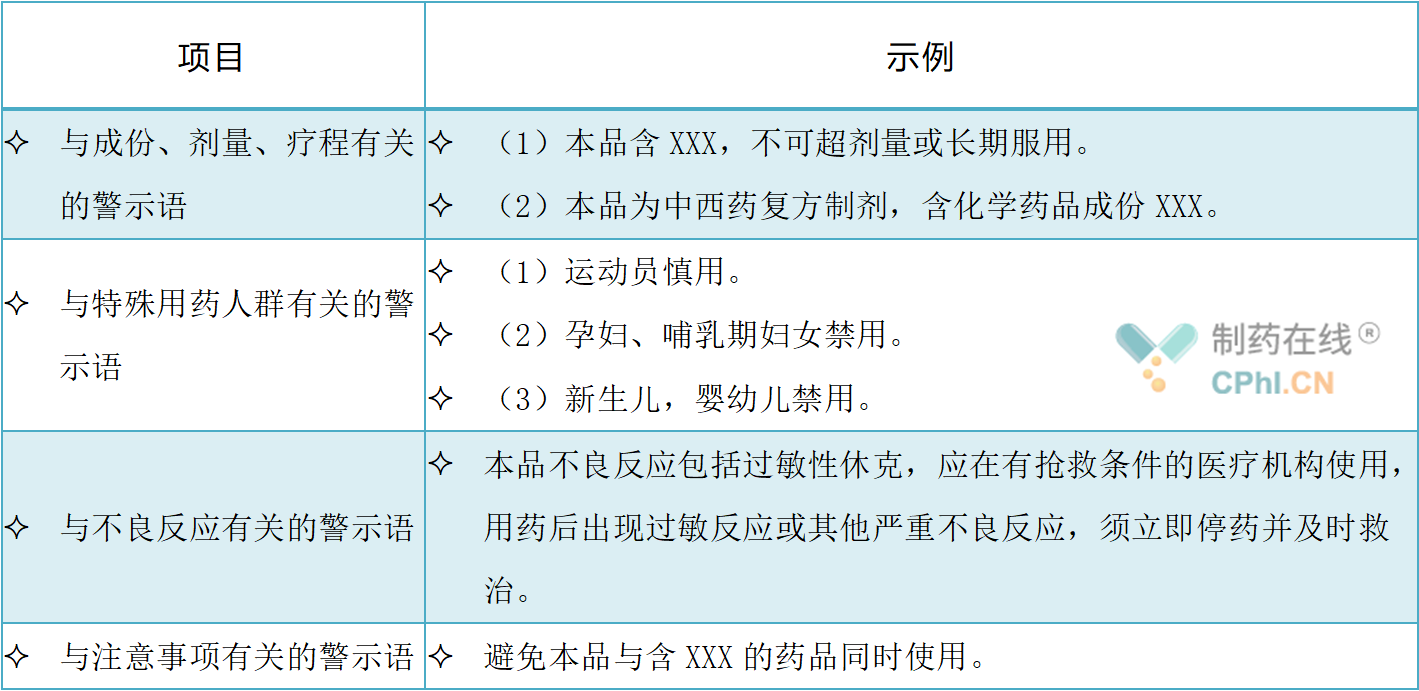
说明书不良反应内容的修订较为复杂,本技术指导原则列出了修订的基本思路和要求。首先要有风险信号来源,其次要进行不良事件与药品的关联性评价,评价标准采用《个例药品不良反应收集和报告指导原则》中的评价标准。要求持有人对不良反应监测系统中反馈的、持有人主动收集的药品不良反应报告进行汇总,对药品不良反应报告的表现及构成比、严重性、关联性、不良反应转归等进行分析,并形成总结。考虑到上市后监测到的不良反应通常不能准确判定其发生率,因此明确要求只列出不良反应名称,而不使用涉及发生率的表述。【不良反应】项信息的修订,一般应考虑的因素如下表:
3、【禁忌】
【禁忌】项内容包括禁止使用该药品的各种情形,包括年龄、性别、生理状态、疾病状态、伴随治疗、中医证候或体质等。【禁忌】项的修订主要基于传统中医药理论对禁忌的认识、现有安全性数据、资料的分析结果,在【禁忌】项中对可能产生严重伤害的情形进行限定。如疾病禁忌、特殊人群禁忌、联合用药禁忌、其他禁忌等。
4、【注意事项】
说明书注意事项是最能反映中医药理论特色的部分,因中医证候、病机或体质等因素需要慎用药者,以及将息法(涉及饮食宜忌、服用方法、护理等)、配伍等方面的使用注意均可在注意事项中体现。鉴于处方药与非处方药说明书安全信息项内容的区别主要在注意事项部分,因此,在“其他需要提示的注意事项”增加:对于非处方药,还应考虑增加保障患者自我药疗安全用药、影响药物疗效因素、特殊人群用药等注意事项内容。示例如下:

5、【特殊人群用药】
经不良反应监测或上市后评价,发现已上市中药可能会给孕妇、哺乳期妇女、儿童、老年患者带来用药风险时,可将有关信息在说明书【特殊人群用药】中予以说明、提示。
参考文献
[1]www.nmpa.gov.cn
[2]www.cacm.org.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57