为进一步推动药品上市许可持有人主体责任的落实,认真贯彻落实国家局及区局深入开展药品安全专项整治行动工作要求,进一步规范企业停产和恢复生产行为,全面排查风险隐患,依据《药品管理法》《药品生产监督管理办法》等法律法规和《国务院关于加强和规范事中事后监管的指导意见》(国发〔2019〕18号)的要求,结合实际,2022年3月25日,宁夏回族自治区药品监督管理局结合宁夏回族自治区药企生产的实际情况,制定了《关于加强药品生产企业停产复产监督管理工作的通知》(宁药监综发〔2022〕18号),本文梳理了药企停产复产监督专项重点检查内容,新政下可供国内药企迎接飞检和自检自纠时参考。
一、药企停产复产法规依据
2020年3月30日,国家市场监督管理总局官网发布《药品生产监督管理办法》,于2020年7月1日起正式施行,宣告新监管时代的到来,对药企停产复产管理提出了较高的要求,其中第46条明确列入国家实施停产报告的短缺药品清单的药品,药品上市许可持有人停止生产的,应当在计划停产实施六个月前向所在地省、自治区、直辖市药品监督管理部门报告;发生非预期停产的,在三日内报告所在地省、自治区、直辖市药品监督管理部门。必要时,向国家药品监督管理局报告。笔者检索了对药企停产复产有要求的省份,目前有北京市药品监督管理局、江西省药监局、黑龙江省药品监督管理局、重庆市药品监督管理局、宁夏回族自治区药品监督管理局有发布相关要求,具体要求如下表:
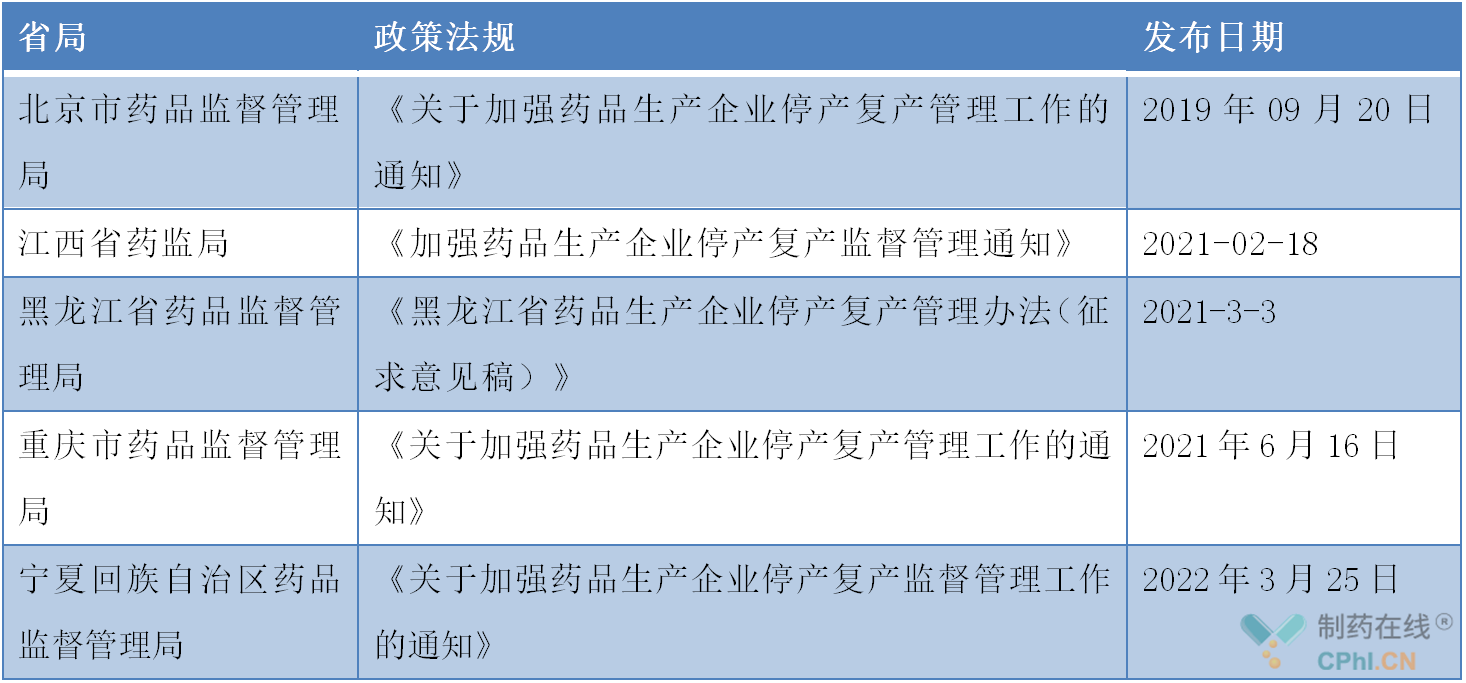
生产企业停产复产管理工作要求的制定是各省局为及时掌握本省药品生产企业的生产状况,进一步规范企业停产和恢复生产行为,加强药品生产企业安全监督管理,消除质量安全隐患,健全风险自查、风险评估、风险自纠、风险控制、风险报告的闭环运行机制。制定本通知。制定本通知
二、宁夏《关于加强药品生产企业停产复产监督管理工作的通知》亮点抢先看
1、哪些企业需要报告?
➢ 无菌制剂生产企业:整厂或某个生产基地(生产线)整体连续停止生产药品3个月及以上的情形。
➢ 其他药企:整厂或某个生产基地(生产线)整体连续停止生产药品6个月及以上的情形。
2、报告时限和向哪里报告要求?
➢ 停产后5个工作日内向宁夏回族自治区药品监督管理局书面报告。
➢ 对于目前已经处于停产状态的企业,应于本通知发文之日起10个工作日内补报书面报告。
➢ 停产涉及列为短缺药品目录、药品储备等品种的,企业除应严格执行国家有关停产报告制度等规定外,还应至少提前6个月向自治区药监局报告。
3、书面停产报告内容?
书面报告至少包括
➢ 停产期间不再开展相关药品生产活动的承诺;
➢ 停产起止日期;
➢ 停产原因;
➢ 涉及的品种(中药饮片生产企业按照生产范围或炮制方法报告)等;
停产企业如涉及特殊管理药品(原料药)的,须加强管理,安排专人负责,实行实时监控,杜绝非法流弊现象。
药品生产企业停产书面报告应经法定代表人(或企业负责人)签字并加盖单位公章。
4、如何恢复生产?
➢ 停产企业恢复生产前,对照药品GMP全面开展自查,认为符合药品GMP规定的,可提出恢复生产的申请。申请资料至少包括申请恢复生产的范围或生产基地(生产线)、自查报告、复产前后的变更情况说明等。
➢ 停产期间,在原址或者异地新建、改建、扩建车间(生产线)或涉及注册管理事项变更的,应按照《药品生产监督管理办法》《药品上市后变更管理办法(试行)》等规定办理。
➢ 停产企业恢复生产时,应向自治区药监局提出书面申请。自治区药监局经过风险评估或综合评定,认为必要的,可进行药品GMP符合性检查。现场检查符合药品GMP规定的,可恢复生产;不符合药品GMP规定的,不得恢复生产。
➢ 药品生产企业应加强自律意识和主体责任意识,按照本通知的要求,报告停产或申请恢复生产。应严格落实药品生产和质量控制措施,必要时对恢复生产前后的药品进行质量对比研究,确保产品质量一致。
参考文献
北京市药品监督管理局、江西省药监局、黑龙江省药品监督管理局、重庆市药品监督管理局、宁夏回族自治区药品监督管理局官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57