2022年6月10日,国家药典委员会官网发布“关于征求《中国药典》药包材生物学评价与试验选择指导原则意见的通知”,征求意见为期1个月。本标准是国家药典委员会按照《“十四五”国家药品安全及促进高质量发展规划》和《中国药典》2025年版编制大纲的规划,组织有关单位及专家拟定了《药包材生物学评价与试验选择指导原则》草案。而此次药包材标准体系拟新增一个新成员标准一旦落地,本指导原则拟推进药包材行业建立以风险管理为基础的生物学评价与试验理念,统一规范药包材生物学试验样品制备和试验条件选择依据,指导使用者科学合理地进行试验和结果评价,对药包材行业具有深远的意义。本文梳理了《药包材生物学评价与试验选择指导原则》中广受制药人关注的若干热点问题。
一、中国特色药包材标准体系简介
药包材对于制药人来说并不陌生,它是直接与药品接触的包装和容器,同时也作为药品的一部分,药包材的质量对药品的安全性、有效性、稳定性产生重要影响,在制剂剂型和生产中起着关键作用,是药品不可分割的组成部分,贯穿药品生产、流通和使用的全过程,直接关系药品质量,药企或药包材生产厂家所需的药包材标准和检测方法参照的更多的是2002-2006年陆续发布的《直接接触药品的包装材料和容器标准汇编》和2015年12月1日起实施的2015版《国家药包材标准(2015版)》,以上两个标准在术语规范以及检验方法、检测限度等质量控制方面都有了较大提升,但是在药包材检测仪器发展的过程中,由于缺乏相关统一的标准,检测仪器技术参差不齐,给药包材的检测也带来很大的困难,同时,由于药品使用的药包材类别较多、原料不同、生产方式差异较大、完全统一模式的药包材生产管理规范难以适应不同种类药包材生产的需要,2020版的中国药典四部在药包材这块做出了一些创新,首次收载新增了16个药包材通用检测方法,弥补中国药典没有详细药包材检测方法的这块空白,目前2020版的中国药典四部已有药包材标准体系的指导原则详见下表:
|
标题 |
来源 |
页码 |
|
4000 药包材检测方法 |
四部 |
374 |
|
4001 121℃玻璃颗粒耐水性测定法 |
四部 |
374 |
|
4002 包装材料红外光谱测定法 |
四部 |
375 |
|
4003 玻璃内应力测定法 |
四部 |
375 |
|
4004 剥离强度测定法 |
四部 |
376 |
|
4005 拉伸性能测定法 |
四部 |
376 |
|
4006 内表面耐水性测定法 |
四部 |
378 |
|
4007 气体透过量测定法 |
四部 |
379 |
|
4008 热合强度测定法 |
四部 |
380 |
|
4009 三氧化二硼测定法 |
四部 |
380 |
|
4010 水蒸气透过量测定法 |
四部 |
381 |
|
4011 药包材急性全身**检查法 |
四部 |
383 |
|
4012 药包材密度测定法 |
四部 |
384 |
|
4013 药包材溶血检查法 |
四部 |
385 |
|
4014 药包材细胞**检查法 |
四部 |
385 |
|
4015 注射剂用胶塞、垫片穿刺力测定法 |
四部 |
387 |
|
4016 注射剂用胶塞、垫片穿刺落屑测定法 |
四部 |
388 |
|
9621 药包材通用要求指导原则 |
四部 |
547 |
|
9622 药用玻璃材料和容器指导原则 |
四部 |
549 |
二、药包材生物学评价与试验选择指导原则分析
1、1个原则—基于风险评价理念的药包材生物学安全评价和试验选择的原则
《药包材生物学评价与试验选择指导原则》给出常见药包材生物学试验样品制备和试验条件选择依据,将会解决使用者在生物学试验样品制备和试验条件选择上存在标准不一致的困惑,在内容上综合现有国内外药包材生物学评价经验,包括2020年版《中国药典》和 YBB 标准,采用对已有数据进行评审与必要时选择补充试验相结合的方式,对药包材进行全面的生物学评价,旨在建立一个基于风险评价理念的药包材生物学安全评价和试验选择的原则,改变完全依赖试验的做法,指导相关方进行科学的评价和试验,减少不必要的重复试验,力争做到既不过度试验,又能控制风险。
2、2个概念—“评价”与“试验”
“评价”与“试验”的概念既有区别又有联系。药包材的生物学风险控制可以通过收集资料进行评价,当已有充分数据时,则不需要再进行试验;也可以通过已有数据评审和补充的生物学试验来实现。
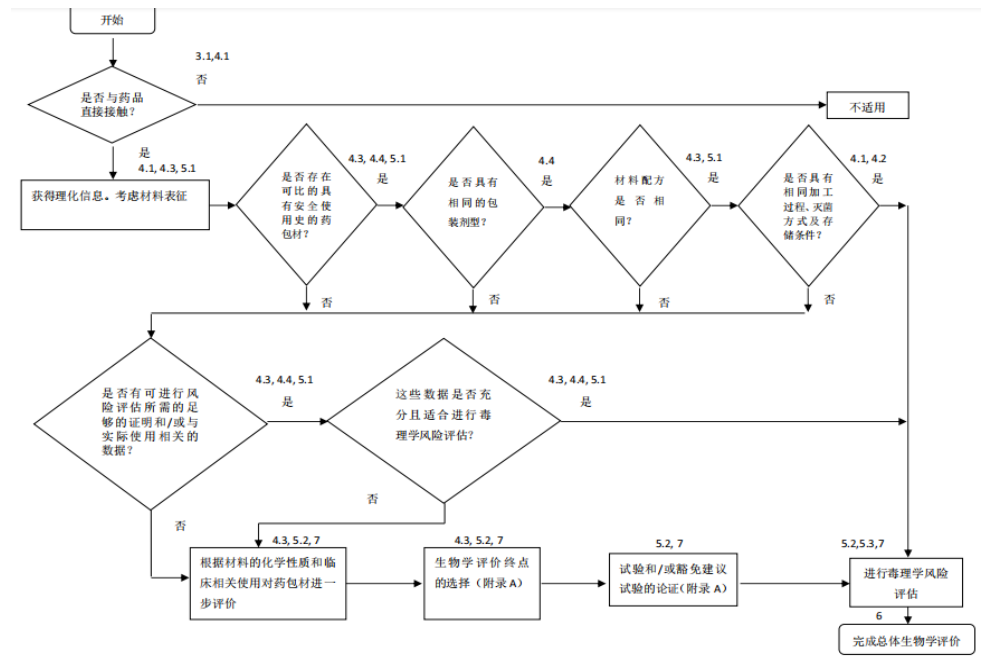
3.药包材生物学评价的决策树
药包材生物学评价一般按以下步骤进行:
a)确定直接接触药品的包装组件;
b) 收集各种组件材料的组成、添加剂(如助剂、涂层、表面处理等)信息;
c) 确定是否存在可比的具有安全使用史的药包材;
d) 药包材与药品的接触方式、接触条件;
e) 药包材及组件生产工艺,包括灭菌过程(如有)、存储条件等;
f) 药包材和组件材料的组成成分、添加剂等已有的毒理学和其他生物学安全数据;
g) 生物学终点和/或试验的选择;
h) 毒理学风险评估,得出药包材是否具有生物学风险的结论。药包材生物学评价的决策树如下图所示:
4.何时进行药包材生物学重新评价?
《药包材生物学评价与试验选择指导原则》列出了需要进行重新评价的几种情况:
(1)制造所用材料来源或与生物学评价相关的技术标准的改变;
(2)药包材和组件的配方、工艺或灭菌的任何改变;
(3)预期用途的任何改变;备注:预期用途的改变既可能是由低风险向高风险用途的改变,比如由口服改为注射,也可能是由高风险向低风险用途的改变,比如由吸入改为鼻吸入。特别是针对由高风险向低风险用途的改变,也应该按照程序进行相应的评价。
(4)临床出现了与药包材相关不良生物反应的任何证据。
参考文献
[1]www.chp.org.cn、中国医药工业杂志
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57