艰难梭菌(CD)又称难辨棱状芽孢杆菌,是一种革兰阳性厌氧芽孢杆菌,是引起院内肠道感染的主要致病菌之一。临床上,约15%-25% 的抗菌药物相关性腹泻(AAD) 、50% ~ 75% 的抗菌药物相关性结肠炎和95% ~ 100% 的伪膜性肠炎( PMC) 是由艰难梭菌感染(CDI)引起。
CDI 主要是由产毒素CD 过度繁殖导致肠道菌群失调并释放毒素所引起,主要临床症状为发热、腹痛、水样便腹泻。CDI 通常由长期或不规范使用抗菌药物引起,轻者引起腹泻,严重者引发伪膜性肠炎,且常伴有中**巨结肠、肠穿孔、感染性休克等并发症,甚至最终导致死亡。据疾病预防控制中心(CDC)报告显示,美国每年约有70万人感染CDI,50万人接受CDI抗生素治疗,复发率约在20%至30%,其中近60%的患者会存在多次复发的风险。此外,美国每年因CDI死亡的人数高达2.9万人,国家投入的CDI急诊设施近48亿美元,被DOC列为紧急公共卫生威胁。
目前,CDI治疗领域还存在很大需求,已获批治疗药物有限,其中万古霉素(vancomycin)和非达霉素(fidaxomicin)是CDI的主流治疗药物。此外,默沙东的Zinplava(bezlotoxumab)于2016被FDA批准用于因感染已在接受抗菌药物治疗及处于高风险CDI的成年患者,以减少CDI复发。值得一提的是,Zinplava是一种单克隆抗体,通过中和CD的毒素B,阻断毒素与细胞结合的能力发挥作用。
随着对CDI的关注,目前全球已出现多款在研CDI新疗法,详见下表。其中SER-109进展较快,已开始滚动递交BLA。
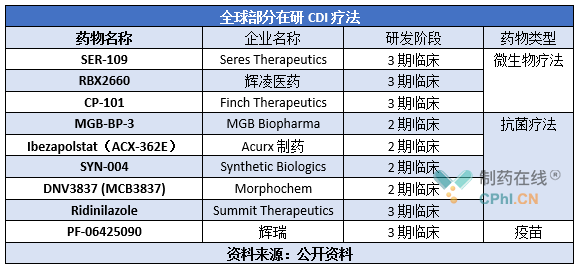
♦ SER-109是来自于健康人粪便中约50种细菌孢子的组合物,旨在减少CDI的复发,曾被FDA授予治疗CDI的突破性疗法认定和孤儿药资格。2020年8月,该药在治疗复发性CDI的关键3期临床试验ECOSPOR III中获得积极顶线结果:与安慰剂相比,SER-109导致给药8周内CDI出现复发的患者比例显著下降,疗效结果超过之前与美国FDA协商确定的阈值。近日,Seres Therapeutics宣布该药在ECOSPOR IV临床试验中取得积极结果:以SER-109治疗的受试者在第8周时有8.7%的复发率。此外,第8周时,CDI首次复发受试者的复发率为6.5%,曾发生2次或以上CDI受试者的复发率为9.7%。基于这些研究结果,公司已开始滚动递交SER-109的BLA。
♦ RBX2660是首 个在3期试验中取得积极初步结果的微生物治疗,旨在阻止CDI的复发,已被FDA授予快速通道资格、孤儿药资格和突破性疗法认定。
♦ CP101是一种研究性口服微生物组药物,以口服肠溶胶囊形式递送完整的微生物群落,旨在通过恢复定植抗性,或健康的微生物组,来防止潜在病原体定植的能力,从而预防复发性CDI,被FDA授予用于预防复发性CDI的快速通道资格和突破性疗法认定。2期临床试验PRISM3结果显示:接受CP101单次给药的复发性CDI患者中74.5%在第8周达到了持续的临床治愈,与对照组患者的61.5%相比,改善具有统计学意义,达到主要疗效终点。
♦ MGB-BP-3是一种抗菌剂,对多种重要的多重耐药和敏感的革兰氏阳性病原菌具有抗菌活性,曾被FDA授予合格传染病产品(QIDP)资格认定。据悉,MGB-BP-3有非常快的杀菌效果,能在艰难梭菌形成孢子之前杀死其营养体,从而通过减少艰难梭菌的总负荷达到初步治愈和防止疾病复发的目的,对目前抗药性最强的的BI/NAP1/027菌株具有很强的杀菌活性。2020年5月,该药一线治疗CDI的2期研究达到安全性、疗效、剂量选择终点,具体数据为:每天2次、连续10天服用250mg剂量MGB-BP-3,可获得100%的初步治愈、100%的持续治愈。
♦ Ibezapolstat是一款DNA聚合酶IIIC抑制剂,曾被FDA授予治疗CDI的合格传染病产品(QIDP)资格和快速通道资格。2020年11月,该药在一项治疗轻中度CDI的开放标签2a期临床试验中达到研究的主要和次要疗效终点:入组试验的所有10名患者治疗结束时均获得临床治愈,而且获得28天随访时CDI无复发的持续性临床治愈。
♦ SYN-004(ribaxamase)是公司开发的同类首 个旨在保护肠道微生物群体免受某些由静脉注射的β-内酰胺抗生素破坏的口服型酶剂,曾被FDA授予治疗CDI的突破性疗法认定。评估该药预防原发性CDI、抗生素相关性腹泻和抗生素耐药性出现的有效性的2b期验证性临床试验结果显示:与接受安慰剂的患者相比,接受 SYN-004的患者的CDI发生率相对降低了71.4%(p=0.045)。
♦ DNV3837 是一种水溶性前药,在人体静脉内给药后会迅速去磷酸化,从而产生药物的活性形式 DNV3681。其结构由两个活性部分组合而成,即抑制细菌 DNA 促旋酶以干扰细菌基因组复制的氟喹诺酮和抑制细菌蛋白质合成起始的恶唑烷酮。
♦ Ridinilazole是一种双苯并咪唑类化合物,X衍射结果显示,Ridinilazole以特定序列的方式与 DNA 的小沟直接结合。2021年12月,Summit Therapeutics宣布该药治疗CDI的3期临床研究失败:与万古霉素相比,ridinilazole的SCR率(SCR定义为治疗CDI的临床反应,并且治疗结束后30天内无感染复发)更高,但未达到该研究的主要优势终点。
♦ PF-06425090是一款CD候选**,旨在通过触发来自这种细菌的两种主要致病毒素的抗体反应,以预防经常发生在医院或长期护理设施中的艰难梭菌感染。今年3月,辉瑞宣布PF-06425090在一项关键性3期试验中未能达到预防感染的主要终点,但在次要终点方面,PF-06425090已被证明具有减少疾病持续时间和改善疾病严重程度的潜力。
整体来看,CDI在研药物种类还是比较多样的,而且部分产品已进入临床后期。期待随着新产品的获批上市,CDI治疗可以迎来新局面。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57