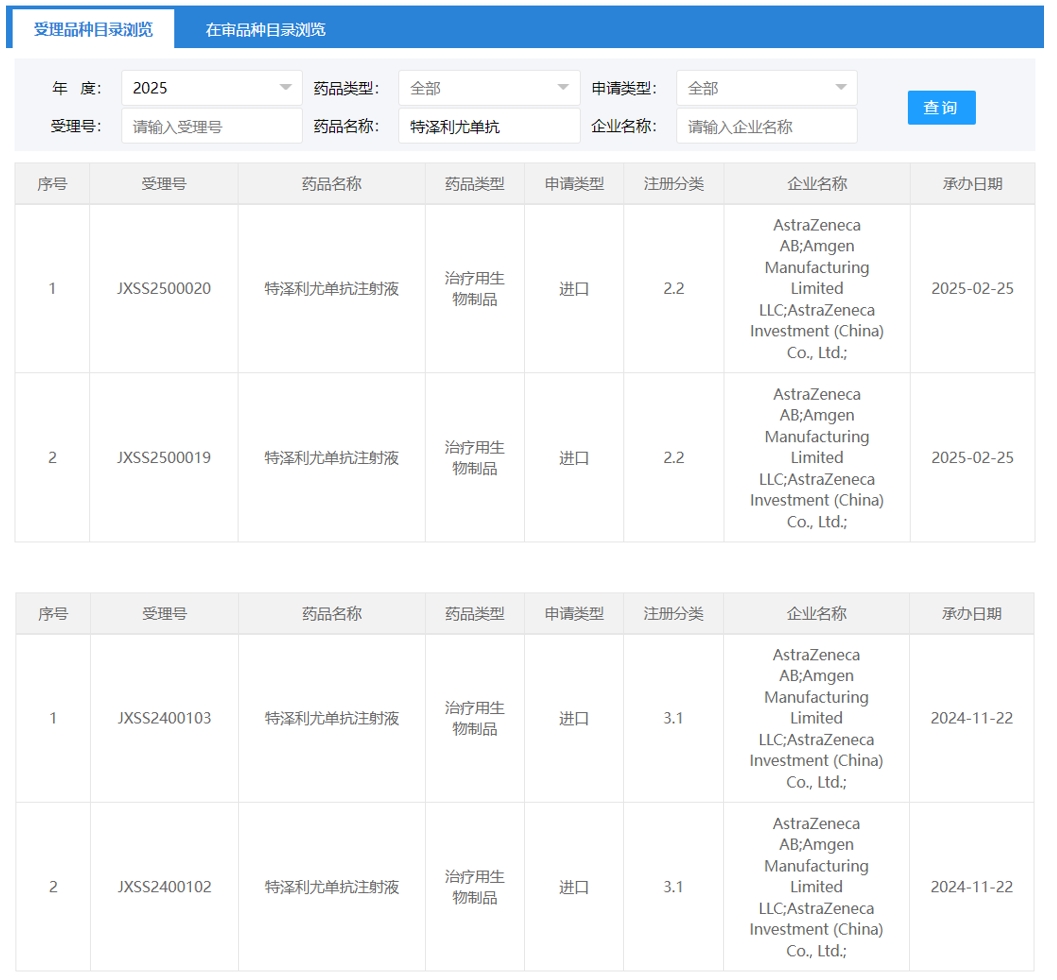
2月25日,阿斯利康/安进递交的特泽利尤单抗注射液的2.2类进口申请获CDE受理。这是特泽利尤单抗在国内申报的第二项适应症,笔者推测为新适应症为慢性鼻窦炎伴鼻息肉病。2024年11月,特泽利尤单抗在国内的首个进口申请获CDE受理,笔者推测适应症为哮喘。
特泽利尤单抗(tezepelumab-ekko,Tezspire)是安进与阿斯利康合作开发的一款首 创胸腺基质淋巴生成素(TSLP)靶向单抗,2021年12月被FDA批准用于12岁及以上儿童和成人重度哮喘患者的附加维持治疗。特泽利尤单抗上市后市场表现不错,2024年其全球销售额首次突破10亿美元,达12.19亿美元。
此外,特泽利尤单抗还被开发用于治疗慢性鼻窦炎伴鼻息肉(CRSwNP)、慢性阻塞性肺疾病(COPD)、嗜酸性食管炎(EoE)等炎性疾病,其中特泽利尤单抗治疗CRSwNP的3期临床研究WAYPOINT已达到共同主要终点。结果显示,特泽利尤单抗治疗组显示出具有统计学意义和临床意义的鼻息肉减小和鼻塞症状减轻。而且,特泽利尤单抗还被FDA授予的突破性疗法认定,用于中度至极重度慢性阻塞性肺病(COPD)的附加维持治疗。
作为全球监管机构批准的首 款且唯一一款TSLP靶向药,特泽利尤单抗的成功给TSLP布局企业巨大信心。TSLP,即胸腺基质淋巴细胞生成素,是一个IL-2类多效能细胞因子,在免疫反应尤其是二型免疫反应中发挥重要作用,参与过敏性疾病、宿主防御、癌症和慢性炎症性疾病等过程。
据不完全统计,全球还有几款在研TSLP靶向药,如Lunsekimig(赛诺菲)、AZD8630(阿斯利康)、Bosakitug(正大天晴)、CM326(康诺亚/石药集团)、LQ043H(洛启生物)、HBM9378/SKB378(和铂医药与科伦博泰)、SHR-1905(恒瑞医药)、Tavo101(拓创生物)、QX008N(荃信生物)。
Lunsekimig是赛诺菲开发的一款IL-13/TSLP靶向双抗,能同时针对两种重要的炎症因子IL-13和TSLP进行作用。已公布的1b期临床数据显示:与单独抑制IL-13或TSLP相比,Lunsekimig展现出更为显著的疗效优势,能有效改善患者呼出一氧化氮分数(FeNO),这一指标是评估气道炎症活动度的重要生物标志物。
而且,欧洲呼吸学会年会(ERS 2024)上公布的体外实验结果显示:与单独靶向TSLP或IL-13相比,Lunsekimig可更有效地抑制胸腺活化调节趋化因子和嗜酸性粒细胞趋化因子的产生。此外,Lunsekimig可显著降低血浆IL-13和TSLP水平,从而下调相关基因的表达,达到抑制炎症的效果。
AZD8630(AMG 104)是一款抗TSLP 单克隆抗体,有望实现每日一次吸入。1期试验结果显示:AZD8630每日一次给药,在评估的剂量下长达 28 天内给药是安全的,且耐受性良好。此外,接受高剂量AZD8630治疗的患者 FeNO 显著降低(与安慰剂相比降低 23%,p=0.037)。
Bosakitug(TQC2731)是正大天晴从博奥信引进的一款TSLP靶向IgG1单抗。1期研究数据显示:Bosakitug具有良好的安全性、免疫原性和耐受性,皮下或静脉给药后终末半衰期为17.2-25.0天,用药频率可实现每月1次。
已公布的Bosakitug治疗的特应性皮炎的3期临床概念验证(POC)试验结果显示:所有受试者在4周内每周接受300mg诱导剂量注射,此后每两周接受1次300mg的维持剂量注射,共10次。直至25周后,共有94%、69%和25%的受试者分别达到EASI(湿疹面积与严重程度指数)75、90和100(EASI评分较基线改善≥75%、90%、100%),研究者整体评估(IGA)0/1(即皮损完全清除或基本清除)达到94%。在最后一次给药后的12周内,所有受试者均维持EASI 75达标。
2024年11月,Aclaris Therapeutics以9.4亿美元的总交易额获得了Bosakitug以及BSI-502在中国以外的权益。2024年12月,Bosakitug在国内治疗重度哮喘的3期临床启动。
CM326是康诺亚研发的一种重组人源化抗TSLP单抗,拟用于治疗中重度哮喘、COPD等呼吸系统疾病,石药集团拥有其在中国大陆呼吸领域适应症的开发和商业化权利。
LQ043H是洛启生物具备完整自主知识产权的抗TSLP纳米抗体药物,其采用雾化吸入给药使得药物直达肺部病灶区,快速起效,同时避免肝脏首过效应,减少系统性暴露毒性,既兼顾了吸入式给药的优势,又规避了皮下给药的副作用。
已公布的1a期临床试验结果显示:与安慰剂组相比,全部给药剂量组受试者单次雾化吸入LQ043H雾化液后,安全性、耐受性良好,无治疗相关的停药情况。药代动力学(PK)研究证实,整体Cmax、AUC随剂量增加而增加,血药浓度变化趋势与前期预期一致。免疫原性研究证实,全部剂量组受试者均未出现药物相关的ADA和NAB,未提示单次给药LQ043H有产生免疫原性的风险。
SHR-1905是恒瑞医药研发的一款TSLP靶向单克隆抗体。1期临床研究显示:SHR-1905具有延长的半衰期,约为80天,支持每6个月给药一次。2023年8月,恒瑞医药与One Bio达成一项高达10.5亿美元的合作,将SHR-1905在大中华区以外的全球范围内开发、生产和商业化独家权利授予One Bio。
HBM9378是一款由和铂医药与科伦博泰联合开发的靶向TSLP的全人源单克隆抗体,其经过改良达到延长半衰期及抑制作用因子的效果,以皮下注射方式给药。2025年1月,和铂医药和科伦博泰与Windward Bio签订许可协议,授权后者在全球范围内(不包括大中华区以及部分东南亚及西亚国家)研究、开发、生产和商业化HBM9378的独家授权,交易总金额近10亿美元。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57