2022年7月19日,CDE官网发布关于公开征求《药物临床试验期间安全性数据快速报告常见问答(2.0版)》意见的通知,征求意见时限:自公示之日起两周。距离上次《药物临床试验期间安全性数据快速报告常见问答(1.0版)》已经过去3年多了,CDE对药物临床试验期间安全性数据快速报告常见问答再次进行了相应调整,本通知广受注册申请人/ CRO专业人士的关注。本文对新旧版《药物临床试验期间安全性数据快速报告常见问答》主要新增修订内容进行了对比分析,希望可以抛砖引玉,帮助大家做好药物临床试验期间安全性数据快速报告工作,如有遗漏,欢迎大家留言补充。
一、解析《药物临床试验期间安全性数据快速报告常见问答(2.0版)》基本框架结构变化
新版《药物临床试验期间安全性数据快速报告常见问答(2.0版)》基本框架结构共包含了34个问题,涉及药物临床试验期间的快速报告范围;快速报告时限;快速报告方式;快速报告主体、账号管理及测试问题;其他问题五大方面,与旧版(2019年版,为2019年4月11日发布并实施)相比,章节总数减少了,字数也减少,框架对照如下表。

二、《临床安全性数据快速报告常见问答(2.0版)》重点变化内容
2022年7月19日,CDE官网发布关于公开征求《药物临床试验期间安全性数据快速报告常见问答(2.0版)》意见的通知,本问答筛选了目前在药物临床试验期间快速报告过程中申请人、CRO等咨询的高频问题及重点关注问题,在《药物临床试验期间安全性数据快速报告常见问答(1.0版)》基础上,对共性问题进行了系统性的汇总和归纳,参考ICH指导原则、国内外相关法律法规要求,从我国监管实际需求出发,给出统一解释和澄清,《临床安全性数据快速报告常见问答(2.0版)》重点变化内容解读如下:
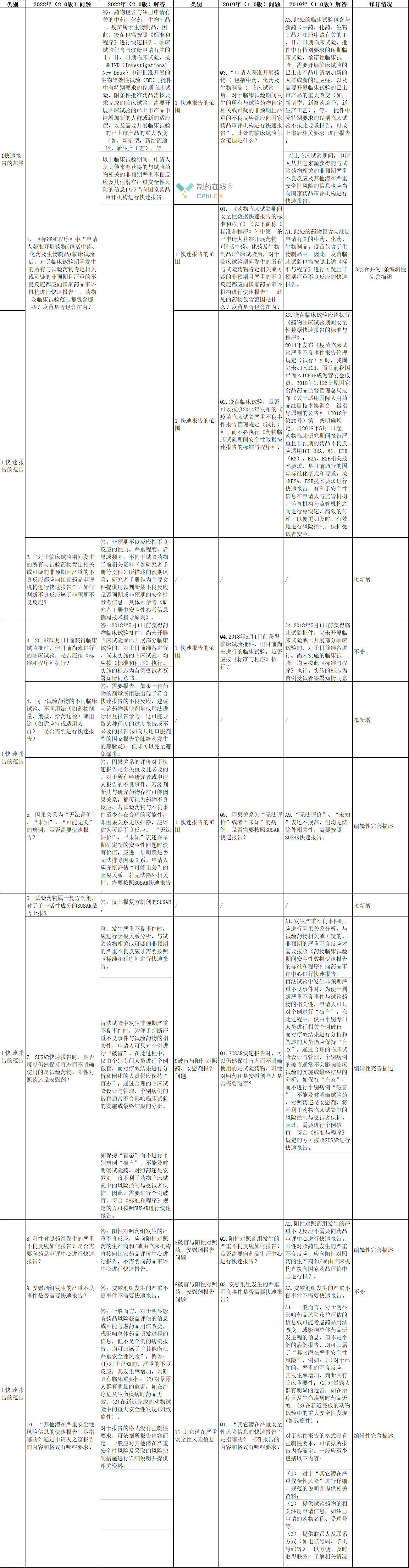
1、快速报告的范围
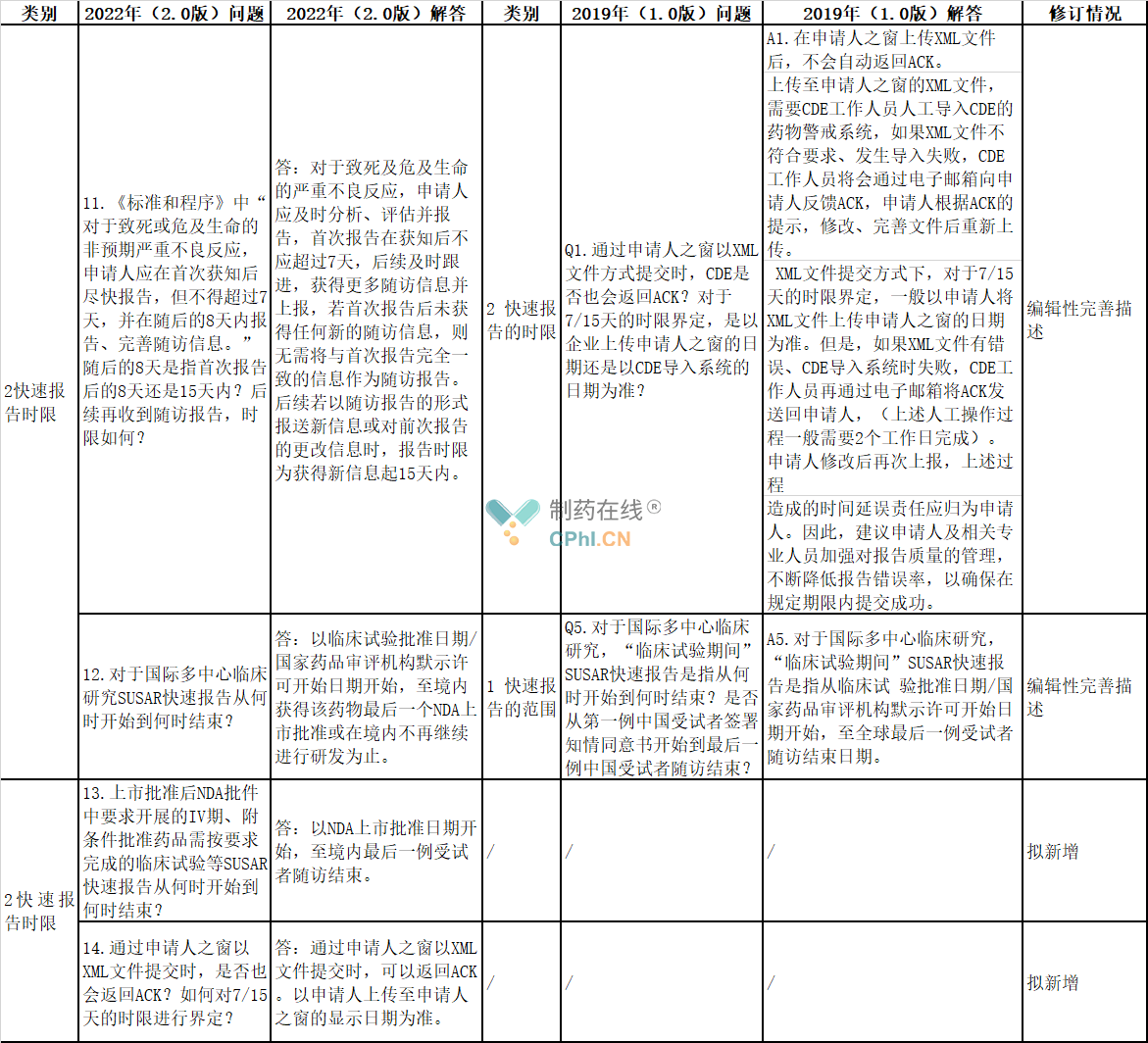
2、快速报告时限
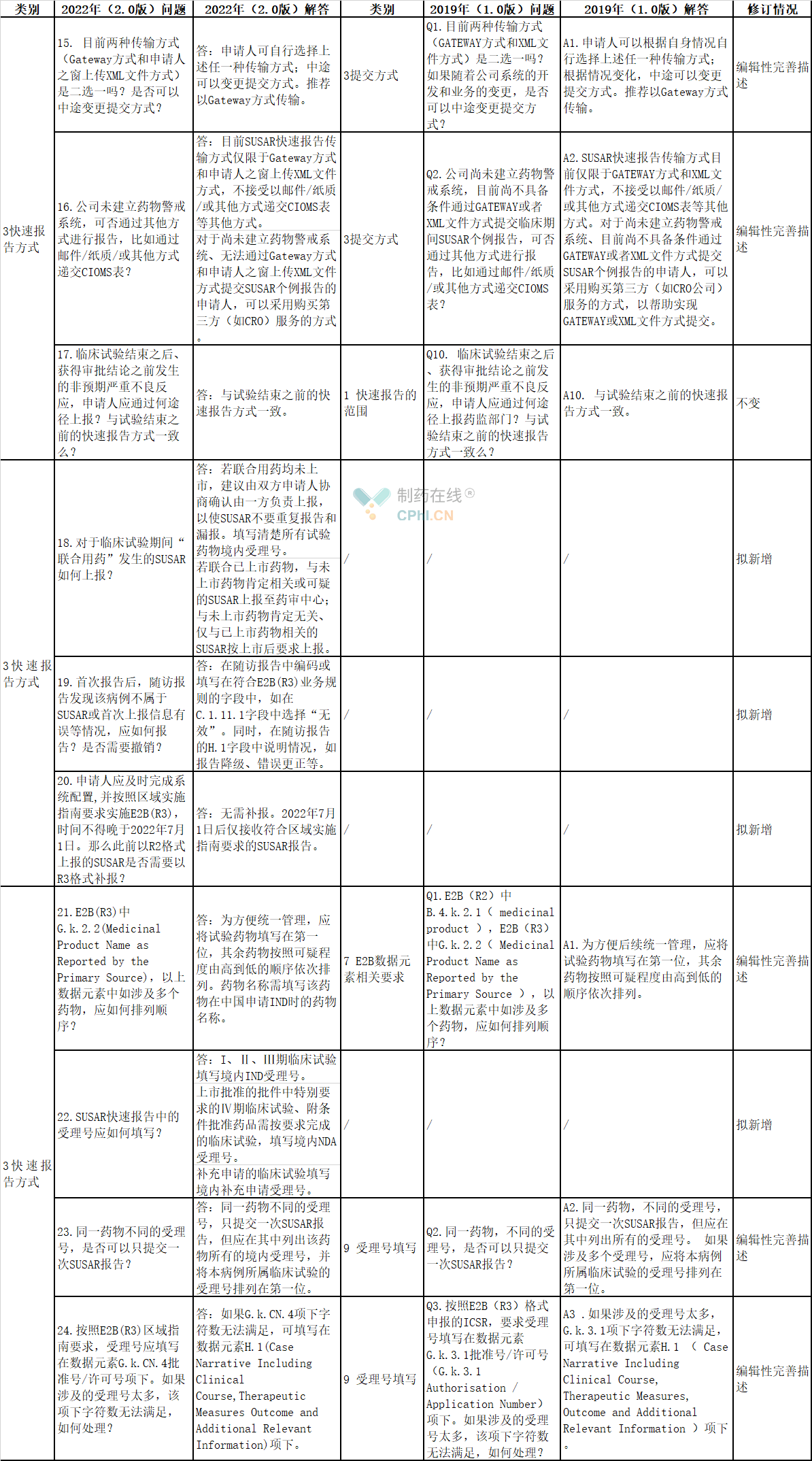
3、快速报告方式
4、快速报告主体、账号管理及测试问题
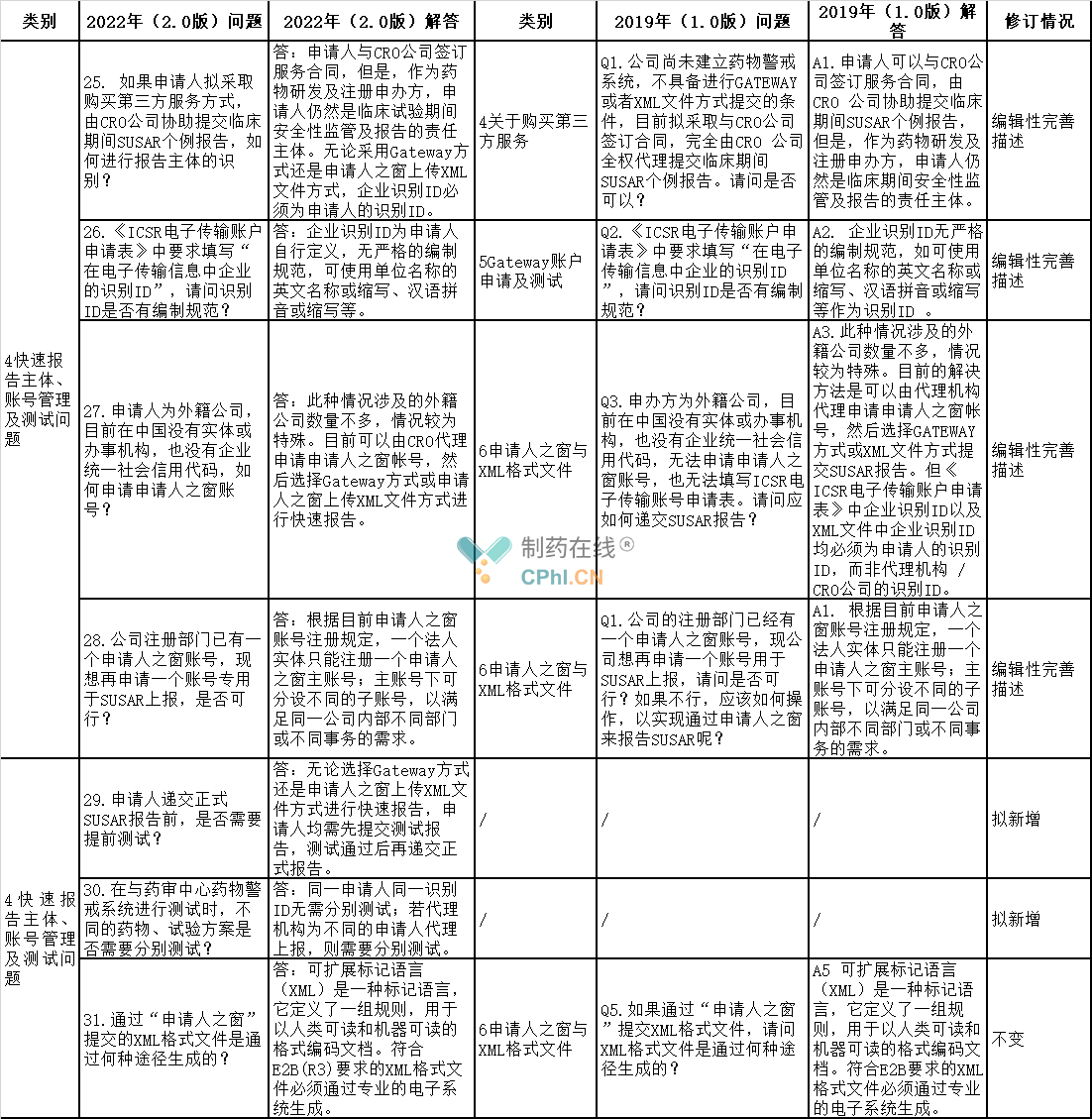
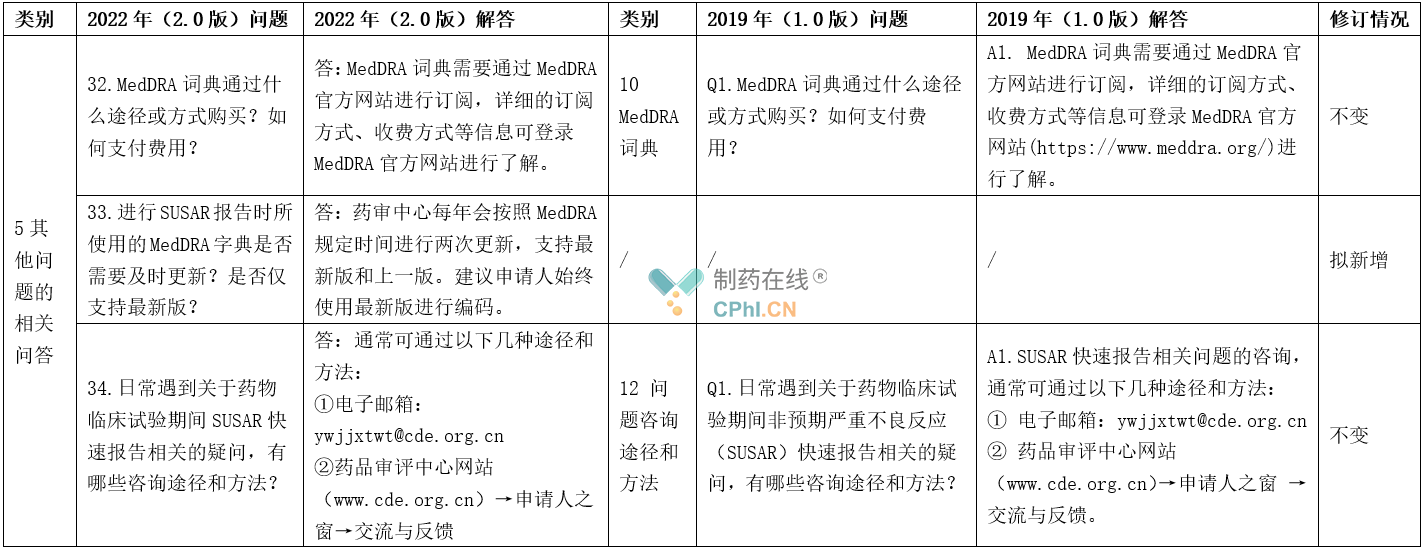
5、其他问题的相关问答
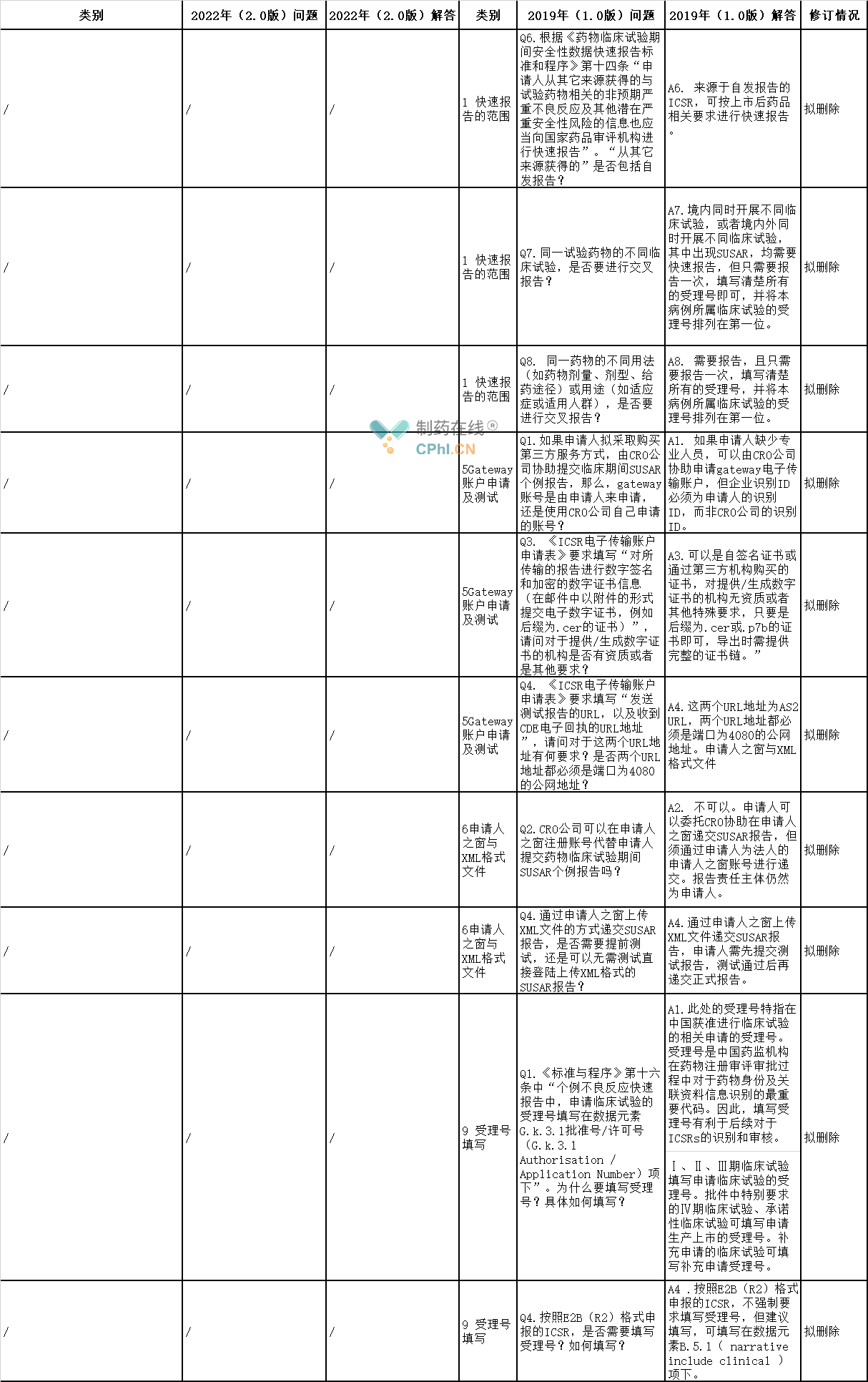
6、拟删除问答
参考文献:CDE及CDE培训PPT



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57