2月20日,安斯泰来(Astellas)宣布,FDA将延长其更年期药物fezolinetant的原定PDUFA目标日期(2023.2.22),延长后定于2023年5月22日,以便FDA有更多的时间来完成审查评估。
PDUFA延期,或与 Fezolinetant III期亚洲临床失败有关
Fezolinetant是一款潜在FIC口服非激素类的选择性神经激肽3 (NKc3) 受体拮抗剂,用于治疗绝经相关中重度血管舒缩症(VMS),其通过阻断神经激肽B(NKB)与Kisspeptin/神经激肽/强啡肽(KNDy)神经元的结合,调节脑(下丘脑)体温调节中枢的神经元活动,以降低绝经相关中重度VMS的发生频率和严重程度。Fezolinetant由比利时药企Ogeda开发,2017年,安斯泰来以5亿欧元(约合5.34亿美元)的价格收购Ogeda获得这款药物。根据券商预测,fezolinetant上市后,2027年销售额有望高达15亿美元。
Fezolinetant分子结构式(来源:Edgar181, Public domain, via Wikimedia Commons)
目前,Fezolinetant共开展了5项临床试验:SKYLIGHT 1、SKYLIGHT 2、SKYLIGH 4、MOONLIGHT 1、MOONLIGHT3。其中SKYLIGHT系列试验是针对美国、加拿大以及欧洲的中重度VMS女性患者进行的;MOONLIGHT系列则是针对中国、韩国中重度VMS女性患者进行。两个系列临床试验结果差异巨大。
先看SKYLIGH系列试验。2022年8月,FDA基于SKYLIGHT 1、SKYLIGHT 2以及SKYLIGHT 4研究结果,接受了fezolinetant的新药上市申请 (NDA),拟用于治疗与绝经相关的中重度VMS。
其中SKYLIGHT 1和SKYLIGHT 2均是随机、双盲、安慰剂对照研究,分别纳入527例和507例患者,旨在评估fezolinetant治疗中重度VMS女性患者的疗效和安全性。结果显示,在第4周和第12周,与安慰剂组相比,fezolinetant组患者发生中重度VMS的频率显著降低且严重程度显著减轻。另外,fezolinetant具有良好的安全性,最常见的不良反应是头痛。
SKYLIGHT 4则是一项随机、双盲、安慰剂对照III期临床试验,共纳入1831例中重度VMS女性患者,旨在评估fezolinetant对患者子宫内膜健康的影响及长期安全性和耐受性。主要终点是第52周时子宫内膜增生和子宫内膜癌的患者比例和第55周时不良反应发生率及其严重程度。结果显示,评估子宫内膜健康的主要终点已经实现,最常见的不良事件是头痛和COVID-19感染,与安慰剂一致。
与SKYLIGHT系列优秀的临床结果不同,在亚洲患者人群中进行的MOONLIGHT 1试验显示,fezolinetant的疗效甚至未能优于安慰剂。
MOONLIGHT 1是一项随机III期临床试验,共招募了来自中国大陆、中国台湾、韩国的302例中重度VMS女性患者,受试者被随机分配,分别服用30mg剂量的fezolinetant或安慰剂,持续24周。另外,该试验的前12周采取双盲和安慰剂对照的方法,随后12周则是非对照延长治疗期。
结果显示,12周后fezolinetant治疗组女性的潮热率较基线水平有所改善,但与安慰剂组女性的差异并没有统计学意义。试验唯一积极的结果是fezolinetant治疗12周的安全性数据与早期试验结果一致。可见,在亚洲试验中,fezolinetant的疗效并未能击败安慰剂。
虽然此次FDA的审批工作是基于SKYLIGHT1、2、4试验进行的,但亚洲区试验的失败,势必会影响FDA对Fezolinetant审批的进度。
VMS亟需新型非激素疗法
VMS是更年期最常见的症状,主要表现为潮热和/或盗汗。据统计,全球40~64岁的绝经女性中大约有57%会受到影响,症状中位持续时间可长达7.4年,极大影响患者的生活质量。
目前对于VMS的治疗,激素替代(HRT)是主要治疗手段。虽然HRT短期内使用有效且总体安全,但长期使用会增加癌症和血栓风险。而且激素治疗需要几个月才能发挥作用,还不能改善更年期女性的睡眠质量。最重要的,在心脑血管疾病和某些恶性肿瘤风险较高的患者中应谨慎使用HRT。
在替代疗法方面,VMS的治疗可选择药物种类有限且具有一定的使用禁忌。因此,以fezolinetant为代表的NK3受体拮抗剂成为治疗VMS的潜力药物。在NK3受体拮抗剂领域,众多药企正在奋起直追,除了安斯泰来外,拜耳的Elinzanetant进度靠前。
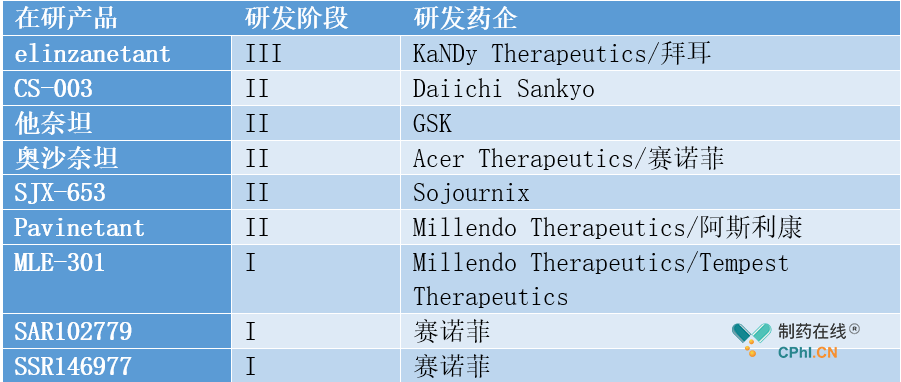
部分在研NK3受体拮抗剂(来源:公开资料)
Elinzanetant最初由英国临床阶段生物技术公司KaNDy Therapeutics Ltd.研发。2020年9月,拜耳完成了对KaNDy公司的收购,并将elinzanetant完全整合到其女性健康产品发展管线。
在更年期女性中,由于雌激素缺乏,导致大脑下丘脑中的一组雌激素敏感神经元(KNDy神经元)变得过度活跃,从而破坏体温控制机制,导致潮热的血管舒缩症状。Elinzanetant通过抑制KNDy神经元的活性以及NK-3受体的信号传导,减少更年期女性中KNDy神经元网络的活动过度,近而使散热效应恢复正常,缓解潮热症状。在名为RELENT-1 和 SWITCH-1的两项II期研究中,Elinzanetant展示了良好的有效性和安全性。目前,Elinzanetant正处于III期临床研究中,目的是评估每天一次120mg elinzanetant用于治疗VMS的疗效和安全性。
作为非激素新药,NK3受体拮抗剂作用时间短,安全性数据良好,为患者提供了一种新的选择,毫无疑问市场潜力巨大。此次安斯泰来Fezolinetant上市遭延期,无疑给拜耳提供了超车的机会,未来谁将率先撞线,我们拭目以待。
参考来源:
1.Astellas provides update on fezolinetant new drug application in U.S.
2.U.S. FDA Accepts Astellas' New Drug Application for Fezolinetant. Retrieved August 18, 2022 from https://www.astellas.com/en/news/26126;
3.Astellas to Present Fezolinetant 12-Week Findings from Phase 3 SKYLIGHT 2? Trial in Oral Session at The North American Menopause Society 2021 Annual Meeting.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57