为进一步指导评估药物临床试验中药物性肝损伤的潜在可能性,保障受试者安全,同时获得安全性信息以评估试验药物的风险特征,2023年7月10日,国家药品监督管理局药品审评中心官网发布《临床试验中的药物性肝损伤识别、处理及评价指导原则》(成文日期:2023年7月7日),自发布之日起实施,本指导原则提出了DILI的监测、评估及处理程序框架,主要用于指导药物临床试验中DILI风险的临床评价,目的在于保障受试者安全,同时获得安全性信息以评估试验药物的风险特征。本文为大家梳理了本指导原则中关于临床试验中的药物性肝损伤识别、处理及评价关键内容并结合自己的解读与大家分享。
一、何为药物性肝损伤(DILI)?
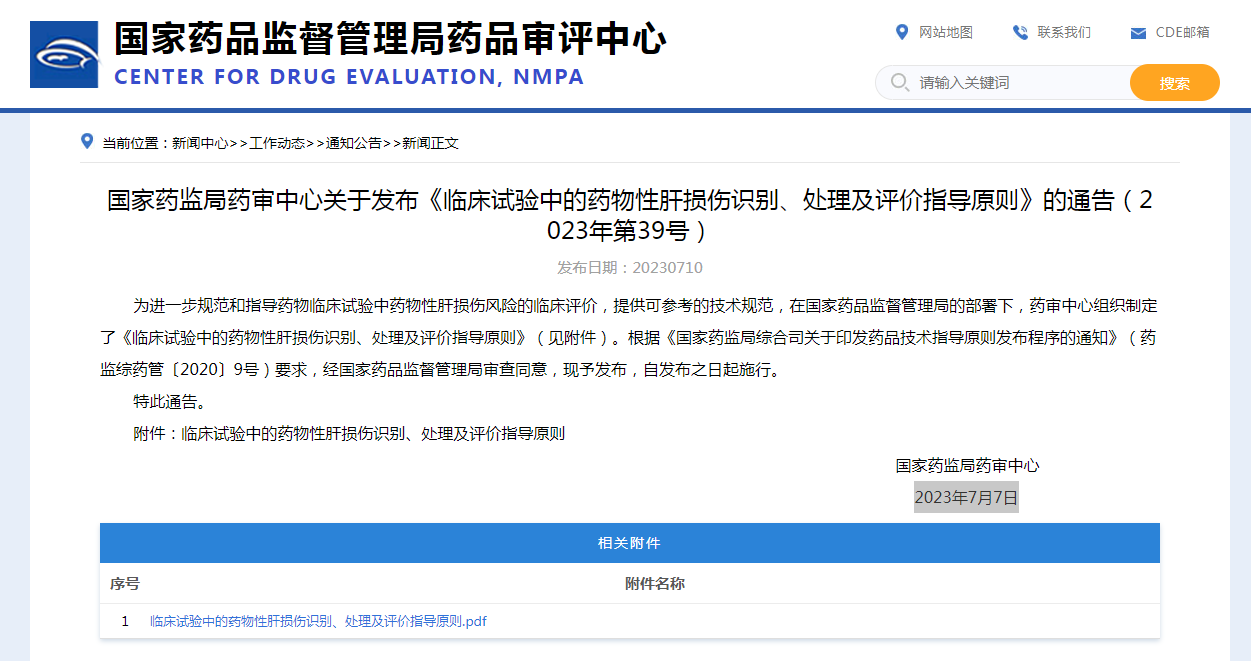
2015年中国首部《药物性肝损伤诊治指南》由中华医学会肝病学分会(CSH)发布,2019年发布《药物性肝损伤基层诊治指南》,结合CDE本次指导原则,药物性肝损伤(英文Drug-Induced Liver Injury,简称DILI)是指由各类化学药品、生物制品、传统中药及其代谢产物乃至辅料等所诱发的肝 脏损伤,DILI是最常见和最严重的药物不良反应之一,当前,由于可引起肝损伤的药物种类繁多,据药物性肝损伤专业网,结合国家基本药物目录(2018版)查询,我国引起药物性肝损伤的常见药物如下表:
我国引起药物性肝损伤的常见药物
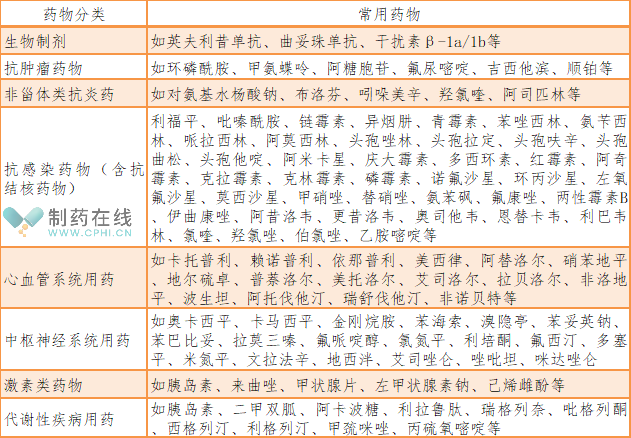
二、药物性肝损伤常见可分为几类?
药物性肝损伤按肝毒 性发病机制可分为固有型、特异质型、间接损伤型。详情见下表:
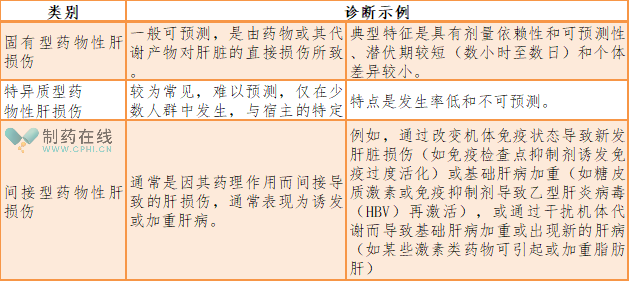
三、无基础肝病的受试者异常肝生化指标的监测、识别和处理的指导流程是什么?
本指导原则建立了无基础肝病受试者异常肝生化指标的监测、评估和评价的指导流程图,以清晰指导药物临床试验中可疑DILI评估和处理。详见下图:
*疲劳、恶心、呕吐、右上象限痛或压痛、发热、皮疹或嗜酸性粒细胞增多(>5%)。
**应实施下文(项目1-3)的完整检查。项目4-5可选,可根据具体情况进行考虑。
(1)完善肝损伤的详细病史,包括症状、体征、既往病史、饮酒史、合并用药史等。
(2)逐步完善血常规、凝血功能、病毒 性肝炎血清学检查、自身抗体等其他实验室检测。
(3)完善肝 脏超声检查,如必要,需考虑进一步的影像学检查。
(4)必要时应考虑肝 脏活检。
(5)如果适用,应获得出院总结、放射学、病理学和尸检报告的复印件。
四、临床试验中的药物性肝损伤个案的处理和报告流程是什么?
1、暂停用药
通常,对于基线肝功能检查正常的受试者,如果出现下列4种情况之一,应停用试验药物:
(1)ALT或AST>8×ULN
(2)ALT或AST>5×ULN,持续超过2周
(3)ALT或AST>3×ULN并且(TBil>2×ULN或INR>1.5)
(4)ALT或AST>3×ULN,并有疲劳、恶心、呕吐、右上腹痛或压痛、发热、皮疹或嗜酸性粒细胞增多(>5%)。
2、密切观察
密切观察,包括收集更详细的病史和动态观察肝 脏生化指标和凝血功能变化,视病情变化复查肝生化和凝血功能指标,开始时,每周复查肝功能检查2到3次。如果异常状况稳定或者试验药物已停用且受试者无症状,则重复检查的频率可降低为每周一次。
3、再次用药
(1)对于基线肝功能检查正常的受试者,ALT或AST显著升高(>5×ULN),且考虑与试验药物有合理相关性的,不应尝试再次用药。
(2)只能在受试者别无替代治疗,且从试验药物的潜在获益大于风险、预期风险可控的情况下,在详细告知受试者再次用药的潜在风险并取得其知情同意后,在密切监测下谨慎进行再次用药。
4、永 久停药
对于暂停用药且没有必要尝试再次用药的受试者,或再次用药后仍出现肝损伤的受试者,应永 久停药。
5、临床试验中的药物性肝损伤报告
(1)病例报告表关键信息
建议在临床试验中设计专门用于评估试验药物引起肝损伤的病例报告表。
(2)快速报告
临床试验中的所有可疑符合海氏法则的病例均应参照ICH E2A指导原则的报告程序进行快速报告。报告应包括所有可获得的信息,尤其是评价事件严重性以及与药物因果关系的必要信息。同时,密切监测直至受试者完全恢复或出现相关临床结局事件,并收集完成补充信息。
参考文献
[1]www.cde.org.cn.药物性肝损伤诊治指南等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57