2023年7月10日,国家药监局CDE官网发布“征求《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)修订稿(征求意见稿)》意见的通知”(成文日期:2023年7月10日),征求截止日期:2023年7月24日。此办法新规为规范CDE临床试验期间安全信息评估与风险管理工作,本文为大家梳理了本指南中临床试验期间安全信息评估与风险管理有关条款内容并结合自己的解读与大家分享。
一、申办者如何构建试验期间药物安全评估能力?
新版GCP第四十七条明确,申办者负责药物试验期间试验用药品的安全性评估。申办者应当将临床试验中发现的可能影响受试者安全、可能影响临床试验实施、可能改变伦理委员会同意意见的问题,及时通知研究者和临床试验机构、药品监督管理部门。临床试验中的安全性评估包含两层含义:
1)一是针对收集到的个例安全性报告做出事件层级的严重性、相关性和预期性的判断;
2)二是要整体关注试验药物在临床前、临床试验中获得的数据,以及同类产品公开的数据,及早发现并评估安全性信号,确认有无新的药物不良反应和重要风险。这不仅是新版GCP的要求,同时也是更新研究者手册和撰写药物研发期间安全性更新报告的重要技术依据。
二、临床试验期间安全信息评估与风险管理指南有哪些新变化?
2020年7月1日,根据《国家药监局关于实施<药品注册管理办法>有关事宜的公告》(2020年第46号),CDE发表于《药物临床试验期间安全信息评估与管理规范(试行)》(见附件),自2020年7月1日起施行。
2021年1月,CDE内部发布实施《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》,该工作程序发布实施两年以来,在中心开展临床试验期间安全性风险监测、识别、评估和控制工作中,特别是在国家疫苗监管体系认证(NRA)的临床试验监管(CT)模块工作中,发挥了严守安全性、保护受试者安全的重要作用。在该工作程序实施的过程中,基于近两年的临床试验安全信息任务启动与风险处理结论情况汇总分析,以及NRA CT模块需完善问题,为增加临床试验管理处的风险评估责任,突出重点风险问题的跨部门风险评估要求,CDE对《药品审评中心药物临床试验期间安全信息评估与风险管理工作程序(试行)》进行修订,在控制风险的同时,优化流程、提高工作效率,主要变化内容梳理如下:
1、优化与修订药物临床试验期间安全信息评估与风险管理工作程序及职责
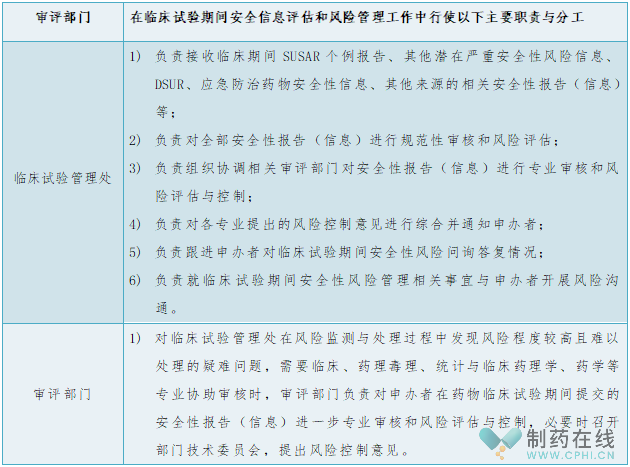
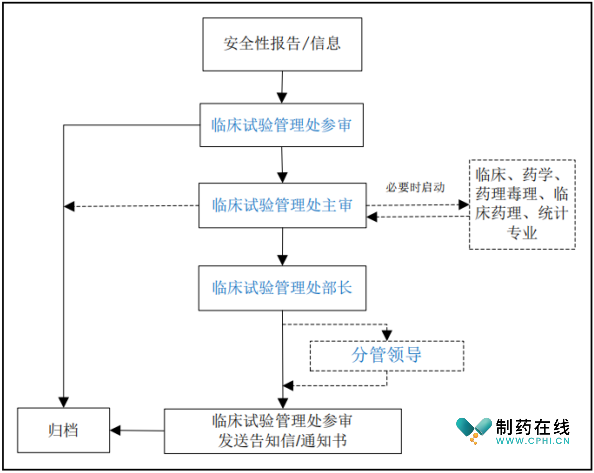
新指南负责风险控制意见的综合部门仍为临床试验管理处,但对相应流程及职责进行了优化与修订。包括第三条临床试验管理处工作职责中明确了风险控制意见综合的职责,第四条审评部门工作职责删除主审报告部相关内容,第六条、第七条对审核流程进行了调整,临床试验期间安全风险管理系统流程图如下图,参与整个工作程序的药审中心的部门和人员主要职责见下表:
2、优化与修订工作时限
新规明确安全性报告(信息)在风险管理系统中的工作时限如下表
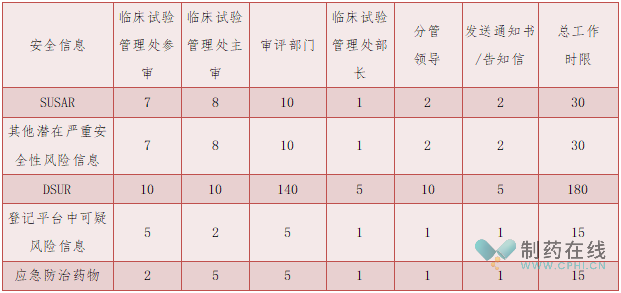
备注:以上时限均为工作日。
3、新增风险管理告知信模板
临床试验管理处审核流程主审审核后做出处理结论,结论为发送通知书/风险管理告知信的,应拟定通知书/风险管理告知信内容。模板如下图:

备注:以上时限均为工作日。
4、5个临床试验风险控制相关通知书模板
CDE形成最终风险处理意见后,对于需要进行风险管理告知、一般风险管理、暂停/终止临床试验的,临床试验管理处主审按照统一格式规范制作《临床试验风险管理告知信》/《临床试验风险控制通知书》/《暂停临床试验通知书》/《终止临床试验通知书》,由参审通过申请人之窗发送给申办者。模板详见下图:





参考文献
[1]www.nmpa.gov.cn、中国医药报



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57