近日,成都康诺行生物医药科技有限公司「司普奇拜单抗注射液」被CDE拟纳入优先审评,用于治疗外用药控制不佳或不适合外用药治疗的成人中重度特应性皮炎。

司普奇拜单抗(CM310)是康诺亚自主研发的一种针对白介素4受体α亚基(IL-4Rα)的高亲和力、人源化抗体,通过靶向IL-4Rα双重阻断白介素4 (IL-4)及白介素13 (IL-13)的信号传导,被开发用于治疗特应性皮炎、过敏性鼻炎、哮喘和慢性鼻窦炎伴鼻息肉等疾病。
2022年11月,CM310被CDE纳入突破性治疗品种,用于治疗中重度特应性皮炎。2023年3月,康诺亚宣布CM310治疗中重度特应性皮炎(AD)的3期确证性临床研究(试验方案编号:CM310AD005)完成揭盲及初步统计分析,达到主要研究终点。
具体数据为:16周时,CM310治疗组达到EASI-75的受试者比例为66.9%,达到IGA评分为0或1分(IGA 0/1,即皮损完全清除或基本清除)且较基线下降≥2分的受试者比例为44.2%,安慰剂组分别为25.8%和16.1%。此外,16周时,CM310治疗组达到每日峰值瘙痒数字评估量表(PP-NRS)较基线改善≥4分的受试者百分比为35.9%,皮肤病生活质量指数(DLQI)较基线改善8.7分,安慰剂组分别为11.7%和4.4分。
安全性方面,CM310安全性良好,CM310组治疗期不良事件(TEAE)的发生率与安慰剂组相当,大多数TEAE严重程度均为轻中度。
此次CM310在国内拟纳入优先审评将加速其上市进程,期待未来CM310早日获批,造福广大中重度特应性皮炎患者。若顺利,CM310将成为国内首 款获批上市的国产IL-4Rα靶向单抗。
关于IL-4Rα及其靶向药进展
在过敏性疾病的发病机理中,Th2扮演关键角色,在Th2细胞介导的2型免疫反应中,IL-4/13处于中枢位置。
IL-4Rα是IL-4与IL-13受体的共同亚基。其中IL-4是一种糖基化的I型细胞因子,主要由T细胞、自然杀伤T细胞、肥大细胞和嗜酸性粒细胞产生。IL-4通过两种不同的受体复合物中的启动信号转导,一种是在造血细胞上表达的I型受体,另一种是在非造血细胞上表达的II型受体。其中I型受体由IL-4Rα和普通γ链/IL-2Rγ亚单位组成,对IL-4具有特异性。II型受体由IL-4Rα和IL-13Rα1亚单位组成,可被IL-4或IL-13激活。
IL-4Rα靶向药通过靶向IL-4Rα同时阻断IL-4与IL-13两条通路,能够显著抑制炎症性Th2细胞,以及下游的参与炎症反应的嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞的活性,有望用于治疗多种2型炎症通路诱导的疾病。
目前,全球监管机构仅批准一款IL-4Rα靶向药,即赛诺菲/再生元的Dupixent(dupilumab,度普利尤单抗)。该药是一种全人源化单克隆抗体,已被批准用于治疗中重度AD、重度哮喘、慢性鼻窦炎伴鼻息肉、嗜酸性食管炎和结节性痒疹。
Dupixent市场潜力巨大,销售额已从2019年的20亿欧元增加到2022年的83亿欧元。不过,Dupixent近期进展并不顺利,其治疗慢性自发性荨麻疹的sBLA惨遭FDA拒批,而且被指控涉嫌"市场操纵"。
此外,全球还有多款在研IL-4Rα靶向药,详见下表。其中康诺亚的司普奇拜单抗进展相对较快,预计有望成为全球第二款获批的IL-4Rα靶向药。
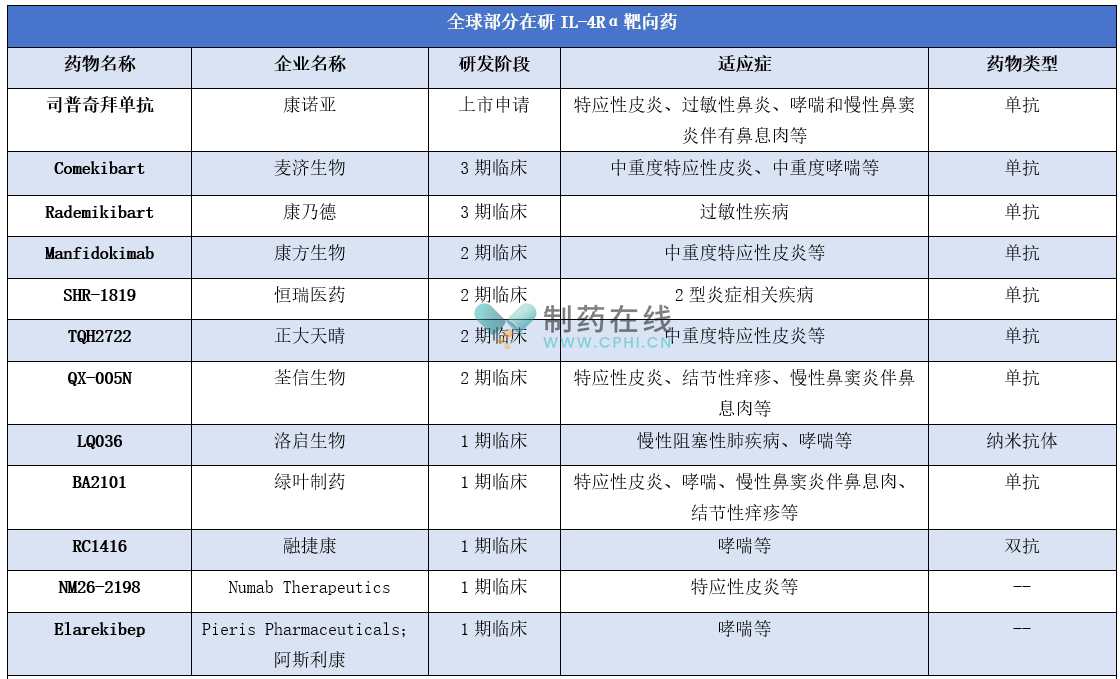
此外,Comekibart和Rademikibart进展也较快,处于3期临床。其中Comekibart(MG-K10)是麦济生物开发的创新型抗IL-4Rα单抗药物,被开发用于治疗中重度AD、中重度哮喘等疾病。治疗特应性皮炎的2期临床试验结果证实MG-K10支持皮下注射300 mg每4周(Q4W)给药。
Manfidokimab(AK120)是康乃德开发的一款人源化IL-4Rα单克隆抗体,能够靶向促炎性细胞因子IL-4、IL-13受体的共同亚基IL-4Rα,从而阻断两种细胞因子介导的途径。
已公布的AK120治疗中重度AD的1期临床研究结果显示:AK120在治疗中重度AD患者中表现出令人鼓舞的初步疗效,并且在安全性方面表现出色。AK120显示出对与AD严重程度相关的炎症指标有明显的抑制作用。值得一提的是,AK120能够显著减少血清胸腺活化调节趋化因子/血清趋化因子配体17(TARC/CCL17)的水平,同时降低血清Ig E水平。此外,AK120对改善AD患者的皮损体征和症状也有显著效果,使湿疹面积和严重程度指数(EASI)评分明显改善,并提高了患者整体评分(IGA)0或1的比例,同时减少了评分下降≥2的比例。
Manfidokimab、SHR-1819等处于2期临床。其中Manfidokimab(CBP-201)是靶向IL-4Rα的全人源单抗。已公布的CBP-201皮下注射给药(SC)治疗中度至重度AD成人患者的全球2期临床试验(NCT04444752)结果显示:CBP-201具有良好的安全性和有效性,且与目前生物制剂疗法相应的临床试验数据相比,CBP-201在临床疗效中显示出差异化优势的潜力。
LQ036、BA2101等处于1期临床。其中LQ036是洛启生物自主研发的抗IL-4Rα纳米抗体药物,也是全球首 个进入临床试验的靶向IL-4Rα的纳米抗体创新药。
1期临床研究数据显示,LQ036在健康受试者中单次给药和多次给药均耐受性良好,没有观察到药物诱导作用和药物剂量增加导致的免疫原性,无严重不良事件报告,总体安全性良好。中国1期临床研究的外周血药效动力学相关的检测数据初步显示出LQ036具有优异的疗效潜力。
BA2101是靶向IL-4Rα的创新长效全人源单克隆IgG4型抗体,给药方式为皮下注射。已完成的临床前研究结果显示:BA2101在食蟹猴中相比同靶点市售药物展现出更长的半衰期和更高的药物暴露量,预期未来在人体上可实现每4周1次的给药周期,而同靶点药物通常采用2周给药周期。
在B-hIL4/hIL-4Rα小鼠哮喘模型中,BA2101与市售药物相比具有相似的药效,并能显著抑制小鼠肺组织中嗜酸性粒细胞的募集和小鼠体内OVA特异性IgE的产生;在B-hIL4/hIL-4Rα小鼠特应性皮炎模型中,等剂量的BA2101与市售药物对血清IgE水平的抑制效果相当,能够明显抑制小鼠耳肿胀。毒理研究显示BA2101在B-hIL4/hIL-4Rα小鼠中安全性良好。
作用靶点上,IL-4Rα靶向药作用靶点并不局限于IL-4Rα。其中RC1416是一款重组抗人IL-4Rα和IL-5单域抗体。
整体来看,IL-4Rα靶向药进展顺利。但今年6月,阿斯利康决定停止哮喘药物elarekibep的中期试验。Elarekibep是一种开发用于治疗哮喘的吸入性IL-4受体α抑制剂。此前一项非临床毒理学研究数据显示,Elarekibep会导致炎症相关的肺组织损伤。
总结
IL-4Rα是过敏性疾病药物研发的潜力靶点,赛诺菲/再生元的Dupixent已取得巨大成功。目前,越来越多的药企开始布局IL-4Rα靶点,其中康诺亚的司普奇拜单抗处于第二梯队,治疗中重度特应性皮炎的上市申请已在国内被CDE拟纳入优先审评。此外,麦济生物、康乃德、康方生物、恒瑞医药等多家国内药企也积极布局IL-4Rα靶点。期待在药企的不懈探索下,IL-4Rα领域早日迎来新成员,造福众多过敏性疾病患者。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57