临床试验数据质量是评价临床试验结果的基石,其重要性不言而喻。近期,全国团体信息平台官网发布了一项重要团体标准——《药物临床试验管理系统数据集规范》(T/SHQAP 016—2024),该标准由上海市医药质量协会精心组织起草,并自2024年08月24日起正式实施。这项标准详细规定了药物临床试验管理系统数据集的数据分类及其具体内容,为临床试验数据管理提供了明确的指导。
该规范全面而细致,涵盖了基础信息数据子集和应用信息数据子集两大部分。其中,基础信息数据子集明确了机构基本信息、试验专业、伦理委员会等数据项的定义及要求,为临床试验的基础信息管理奠定了坚实的基础。而应用信息数据子集则进一步规定了临床试验项目管理和机构年度报告等数据项的定义及要求,确保了临床试验项目管理的规范性和机构年度报告的准确性。这项标准的实施,无疑将进一步提升临床试验数据的质量和管理水平。
一、药物临床试验数据管理相关法规概述
临床试验数据质量是评价临床试验结果的基石,对于确保临床研究数据的真实性、完整性、一致性和可靠性至关重要。为了保障临床试验结果的准确可靠与科学可信,近年来,国内监督管理部门发布了一系列法规、规定和指导原则,旨在全面规范临床试验数据管理的流程。这些法规和指导原则包括但不限于《临床试验的电子数据采集技术指导原则》、《药物临床试验数据管理与统计分析的计划和报告指导原则》、《临床试验数据管理工作技术指南(2016年第112号)》以及《药物临床试验质量管理规范》等,共同构成了药物临床试验数据管理的重要法规体系。
二、《药物临床试验管理系统数据集规范》标准信息

三、《药物临床试验管理系统数据集规范》起草单位、起草人和主要技术内容

四、《药物临床试验管理系统数据集规范》技术要求
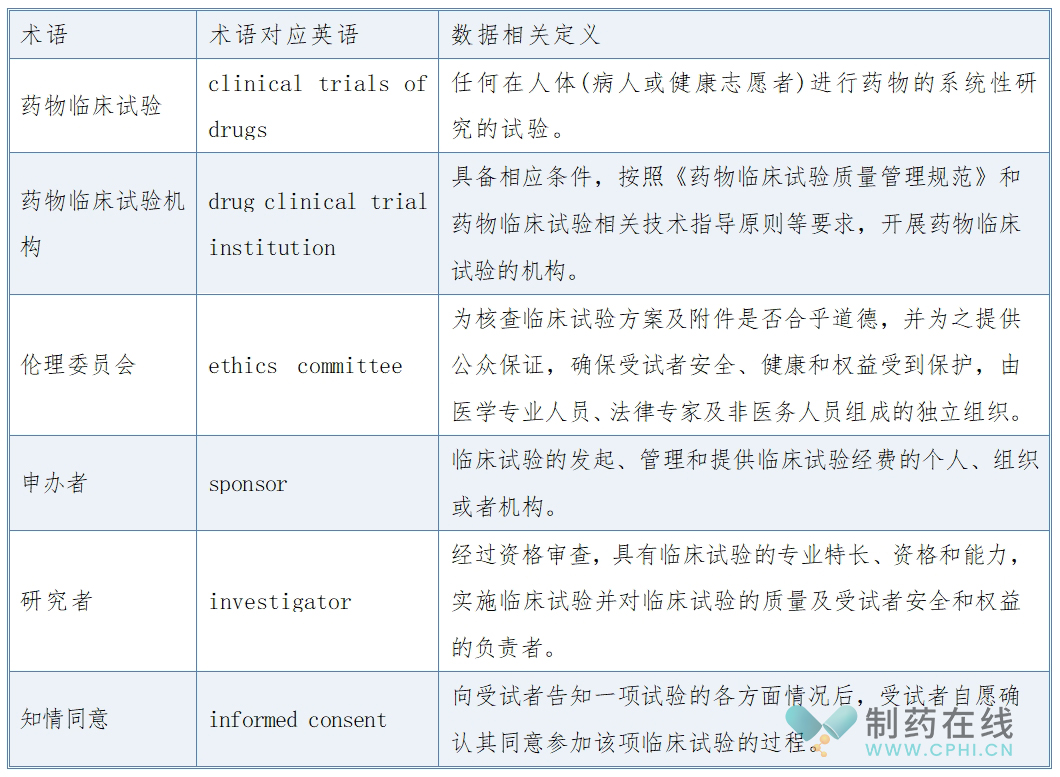
1、药物临床试验数据集概述及相关专业术语
《药物临床试验管理系统数据集规范》(T/SHQAP 016—2024)详细规定了药物临床试验管理系统数据集的数据分类及其具体内容,关于药物临床试验数据集的相关专业术语,可参见下表:
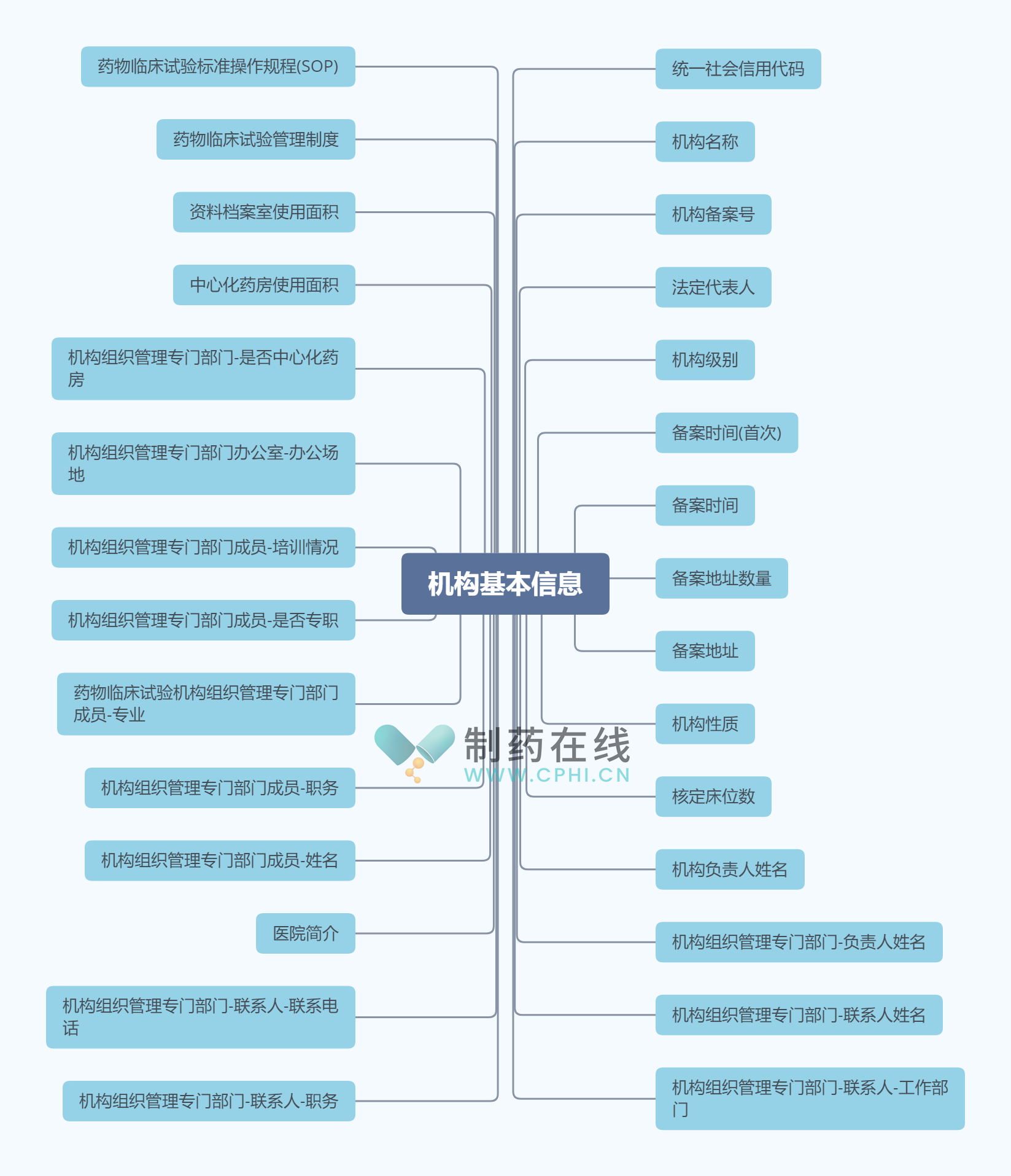
2、机构基本信息数据子集数据元示例
《药物临床试验管理系统数据集规范》(T/SHQAP 016—2024)详细规定了机构基本信息数据子集的内容,该子集全面涵盖了药物临床试验机构的基础信息。具体包括机构的统一社会信用代码、名称、备案号等核心标识信息,以及法定代表人、机构级别、备案时间和地址等关键管理信息。此外,还涵盖了机构性质、核定床位数、负责人和专门管理部门成员的基本信息,包括姓名、职务、专业背景、专职情况、培训经历等。同时,该子集还涉及机构组织管理专门部门的详细信息,如办公场地、是否设有中心化药房、药房和资料档案室的使用面积等。最后,还包含了药物临床试验管理制度和标准操作规程(SOP)等重要文件信息,为药物临床试验管理提供了全面、详尽的信息支撑,详见下图。
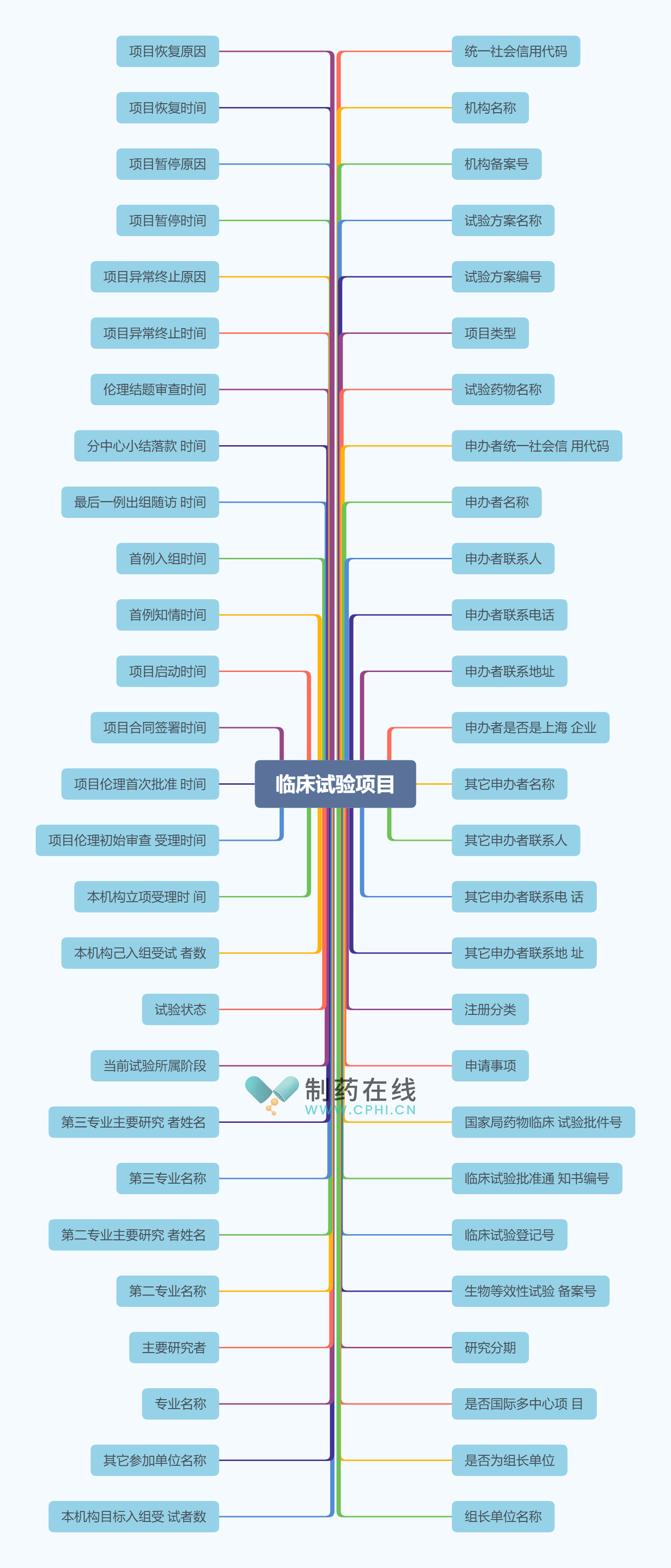
3、临床试验项目数据元示例
临床试验项目数据子集内容详尽,涵盖了从试验基本信息到具体执行阶段的各类关键数据。具体包括试验方案名称、编号及项目类型,明确了试验药物名称及申办者的详细信息,如统一社会信用代码、名称、联系人、联系电话和联系地址,并特别指出申办者是否为上海企业。此外,还包含了注册分类、申请事项等国家局药物临床试验的相关批件号和通知书编号,以及临床试验的登记号和生物等效性试验备案号。
数据子集中还详细记录了研究分期、是否国际多中心项目、组长单位信息等,同时列出了本机构及其他参加单位的目标和实际入组受试者数。专业名称、主要研究者及第二、第三专业的主要研究者也被明确记录。
关于试验的进度和状态,数据子集包含了当前试验所属阶段、试验状态、立项受理时间、伦理审查受理及批准时间、合同签署时间、项目启动时间等多个时间节点,以及首例知情、入组时间,最后一例出组随访时间等,全面反映了试验的进展。最后,还包含了分中心小结落款时间、伦理结题审查时间、项目异常终止及暂停和恢复的时间与原因,为临床试验项目的管理提供了全面、详细的数据支持,详见下图。
参考文献
[1]www.ttbz.org.cn等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57