近期,全国团体信息平台与上海市医药质量协会官网联合发布了《生物制品生产生物安全管理规范》(T/SHQAP 015-2024)团体标准,该标准由上海市医药质量协会等共同起草,旨在满足我国生物制品生产和检验生物安全管理的迫切需求。文件详细规定了生物制品生产生物安全管理体系在风险管理、机构与人员、生产设备设施等多个方面的要求,适用于生物制品生产过程中的生物安全管理。鉴于生物制品生产过程中可能涉及高风险的病原微生物操作,一旦发生事故将对人群和国家造成巨大危害,因此,新建生物制品生产企业或新增产品时,需开展风险评估,并确保风险管理贯穿于生物制品生物安全管理的全过程。基于风险分析的生物安全管理体系是WHO推荐的,也是我国在此次国标推进中明确要求采用的体系。
本文结合ICH Q9(R1)《质量风险管理》,梳理了基于风险分析的生物制品生物安全管理体系构建,包括以下几个步骤:
一、风险管理准备
1. 收集生物安全相关资料
在进行生物安全风险评估前,企业应收集生物安全风险管理资料,包括但不限于相关法律法规、部门规章和标准、规范等,产品的生产工艺、设施设备、病原微生物特性(例如毒力、感受性和传播性)等相关信息。
2. 制定风险评估实施方案
制定风险评估方案前,应明确人员分工和职责、时间安排以及培训、监督考核等内容,规定适用的风险评估方法、应保存的记录以及与其他项目、过程和活动的关联等。
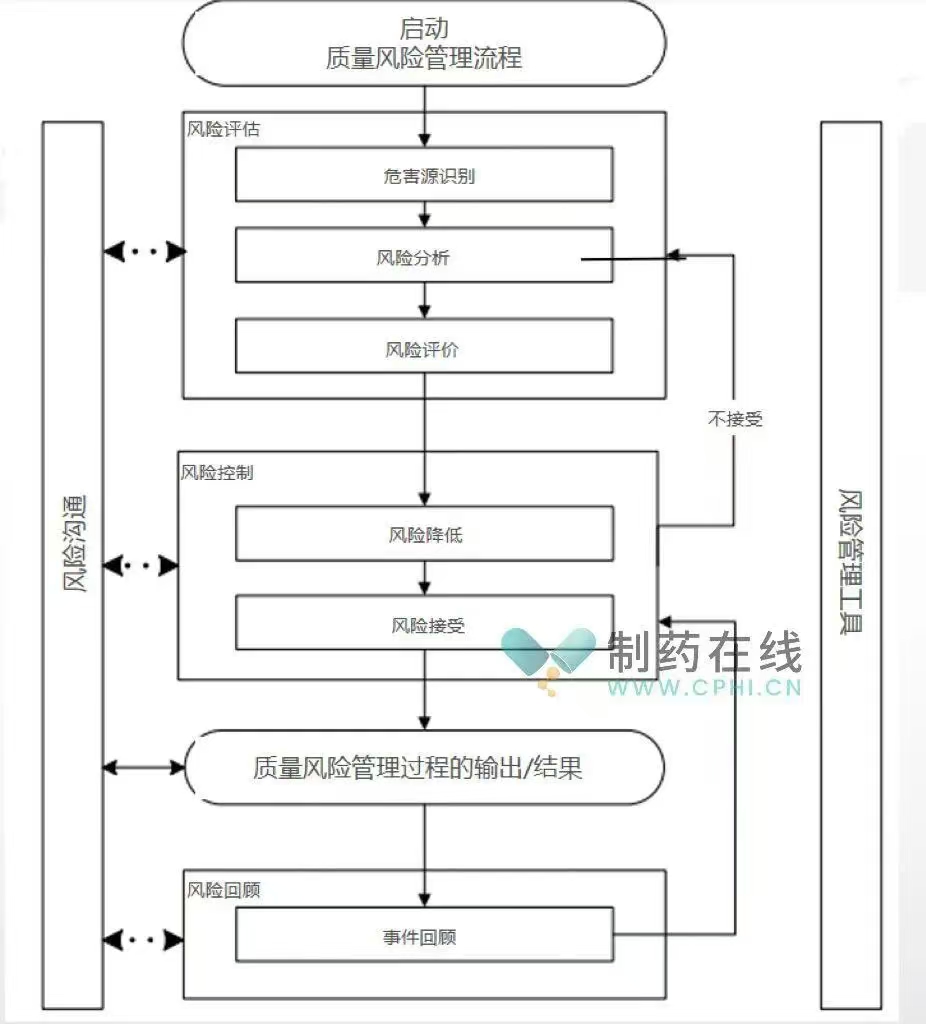
二、风险评估
此环节包括危险源识别、风险分析和风险评价。通过系统地运用信息识别人员、设施、生产操作及检定涉及的病原微生物等风险,对风险进行估计,并将风险与给定的可接受标准进行比较,以确定风险等级。
1. 危险源识别
需要对其可能的风险点进行仔细识别,操作活动的风险识别应考虑(不限于)以下内容:
|
项目 |
危险源识别内容(示例) |
|
人员相关的风险 |
人员的专业知识和技能、生物安全意识、健康状况、心理状况和行为习惯等; |
|
设施、设备、材料和外部服务等相关的风险 |
清洁消毒和清场、交叉污染、防护保障条件失效等风险; |
|
生产操作及质检涉及的病原微生物的特性 |
来源、传染性、传播途径、易感性、潜伏期、剂量-效应(反应)关系、致病性(包括急性与远期效应)、变异性、在环境中的稳定性、与其他生物和环境的交互作用、相关实验数据、流行病学资料、预防和治疗方案等; |
|
生产操作及质检涉及生物安全方面的危险化学品等风险 |
在生产操作及质检过程中,生物安全方面的危险化学品风险显著。操作人员若未正确佩戴防护装备或违规操作,可能导致化学品溅出、泄漏或吸入,引发中毒、灼伤或火灾等事故。质检环节同样存在风险,不当操作或实验室环境不达标可能导致化学品误用、泄漏或混合反应,进而造成爆炸、中毒等危险,对人员和环境构成严重威胁。 |
|
生产操作及质检过程中涉及的病原微生物泄漏、感染等风险 |
在生产操作及质检过程中,病原微生物的泄漏与感染风险不容忽视。操作不规范、设备缺陷或老化可能导致病原微生物在生产环节意外泄漏,尤其是当操作人员未佩戴适当防护装备时,微生物气溶胶的扩散将增加感染风险。质检过程中,样本处理不当、实验室环境不达标或质检设备故障,同样可能引发病原微生物的泄漏,对人员和环境构成潜在威胁。 |
|
病原微生物被误用或恶意使用,及防护区被非法入侵等生物安保的风险 |
病原微生物的误用或恶意使用风险,主要源于实验室内部操作失误、安全意识不足或外部恶意势力的渗透。操作不当可能意外释放病原微生物,而外部势力若渗透实验室或盗取病原微生物,则可能实施生物恐怖袭击,带来灾难性后果。同时,防护区非法入侵风险亦不容忽视,管理漏洞或安全措施不到位可能导致未经授权人员进入,破坏设施,泄漏病原微生物,威胁周边环境和人员安全。 |
|
实验动物相关的风险(如有) |
动物的抓伤、咬伤、致病菌感染等风险; |
|
其他风险 |
如地震、水灾、火灾等自然灾害风险及意外事件、事故带来的风险; |
2. 风险分析及判定
风险分析及判定是人用生物制品生物安全管理的重要环节。企业应基于风险事件发生可能性及后果严重性的原则,进行定性和定量分析,并参照相关规范确定风险等级。根据企业自身实际,判断风险的可接受程度。对于可接受风险,维持现有生物安全管控措施;对于不可接受风险,需采取相应管控措施,以消除、降低或控制风险,确保企业安全运营。
三、风险控制
根据风险评价结果,企业需确定风险是否可接受。若风险可接受,则保持现有生物安全管控措施;若风险不可接受,则应采取措施降低风险,如消除危险源、降低风险发生可能性或严重程度、采用个体防护装备等。
四、风险评估报告
企业应建立风险评估报告制度,全面详尽记录风险评估过程、结论及风险控制措施,作为生物安全管理体系、操作规程和风险管控的重要依据。报告内容需包括名称、目的、范围、日期人员、依据、方法流程、内容及结论等。
五、风险沟通和回顾
企业应建立风险沟通流程,确保与内外部相关方及时沟通风险信息,以便共同应对风险。企业应定期开展风险评估或对风险评估报告进行复审,以确保管控效果满足预期。当相关政策、法规、标准等发生改变,或发生生物安全事件、事故时,应及时进行再评估。在特定情况下,企业应进行风险再评估,在以下情况(不限于)需要进行再评估:
(1) 相关政策、法规、标准等发生改变;
(2) 发生生物安全事件、事故;
(3) 采用新的生产工艺或改变已经过风险评估确认的生产工艺时(包括病原微生物、生产规模、设施、设备、人员、材料、活动范围、管理等);
(4) 企业生物安全委员会根据风险控制的需要,认为应该再评估。
六、《生物制品生产生物安全管理规范》标准信息
|
项目 |
内容 |
|
标准号 |
T/SHQAP 015—2024 |
|
中文名称 |
生物制品生产生物安全管理规范 |
|
英文名称 |
Biological products production—Specification for biosafety management |
|
发布日期 |
2024年07月09日 |
|
实施日期 |
2024年08月08日 |
|
归口单位 |
上海市医药质量协会 |
|
起草单位 |
上海药品审评核查中心、上海市生物医药科技发展中心、上海市质量监督检验技术研究院、上海生物制品研究所有限责任公司、上海莱士血液 制品股份有限公司、上海复星凯特生物科技有限公司、上海君实生物医药科技股份有限公司、上海青赛生物科技股份有限公司 |
|
起草人 |
吴浩、梅妮、周坛树、刘芬、吴莹、曹文峰、蔡子洋、李积宗、史彤、程云斌、刘晨光、吴腾捷、王彧、富宁、余进、吴培颖、张烽均、李建平、张震、安祺、谭立功 |
|
首批承诺执行单位 |
上海生物制品研究所有限责任公司、上海莱士血液 制品股份有限公司、上海复星凯特生物科技有限公司、上海君实生物医药科技股份有限公司、上海青赛生物科技股份有限公司。 |
参考文献
1) https://www.ttbz.org.cn



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57