为深化药品监管领域政务服务增值化改革,浙江省药品监督管理局于2024年11月27日正式发布《浙江省药品监管领域推进政务服务增值化改革实施方案》(浙药监规〔2024〕3号),该方案将于2024年12月27日起正式实施。此次改革方案以习近平新时代中国特色社会主义思想为指导,致力于满足群众和企业的迫切需求。在药品监管领域基本政务服务便捷化的基础上,通过制度创新和数字赋能的“双轮驱动”,协同政府、社会、市场三方力量,构建一个更加精准、便捷、优质、高效的服务新生态。这不仅将提升群众和企业的获得感,也将推动生物医药与医疗器械产业集群的建设。
本文对该方案中药品变更提速增效的关键要点进行了梳理,旨在为行业提供参考。但请注意,具体操作和要求应严格遵守各省根据实际情况制定的详细流程和规定。
一、优化药品上市后变更管理
本措施针对中外共线生产的药品变更管理提出优化措施。对于已获得国外药品监管机构如FDA/EDA/EDQM/MHRA/PMDA批准或WHO预认证等批准的变更,若原料药生产企业遵循上市后变更指导原则,完成必要的研究、评估和验证,并通过申请沟通交流,满足要求的变更可降低管理类别,从而减少企业实施变更的时间。这一措施旨在加速药品变更流程,减轻企业负担,同时确保药品的安全性、有效性和质量可控性不受影响,促进药品监管与国际标准接轨,提高监管效率,提供了简化的管理类别和缩短变更时限的可能性。这有助于企业更快地响应市场变化,提高药品上市后的竞争力。

二、优化药品生产场地变更管理
本措施针对药品生产企业内部生产场地变更提出简化程序。适用于已在《药品生产许可证》登记且通过GMP检查的生产场地,不涉及中等及以上风险变更,以及非实质变更如洁净区面积调整。符合条件的变更可免提交研究资料和现场核查,旨在减轻企业行政负担,提升审批效率,同时确保药品安全和质量。此举平衡了监管严格性和流程简化,促进了药品生产的高效监管。

三、开展审评审批联动联办改革
这一措施通过提供指导、核查等一站式服务,将药品重大变更审评时限从200个工作日大幅压缩至60个,显著提高审评效率。在有条件地区试点省市联动审评审批机制,简化中等变更和生产许可变更流程。对于已通过GMP检查的委受托生产线和车间,若双方均在省内且品种非高风险,经企业评估和市药监部门确认后,可免除药品生产许可变更的现场检查,进一步优化审批流程,减轻企业负担。

四、开展药品生产企业搬迁变更“一件事”改革
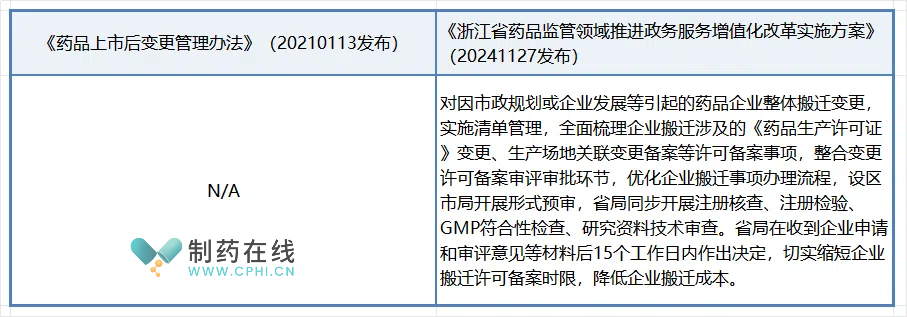
本措施针对药品企业因市政规划或自身发展需要进行的整体搬迁变更,提出了优化管理流程的措施。实施清单管理,梳理《药品生产许可证》变更、生产场地变更备案等事项,整合审评审批环节,简化搬迁流程。设区市局先行预审,省局并行进行注册核查等,确保在收到申请后15个工作日内完成决策,缩短许可备案时限,降低企业搬迁成本。这一改革旨在提高行政效率,减轻企业负担,确保药品生产的连续性和合规性,同时保持监管的严格性和科学性。
参考文献
[1]NMPA、浙江省药品监督管理局官网等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57