
近期,备受瞩目的《生物医药厂房设计GMP合规导则》(T/SHQAP 017-2024),由上海市医药质量协会精心制定,并将于2025年1月23日正式生效。这一里程碑式的规范,不仅为生物医药厂房设计在GMP合规方面设立了清晰的标准,同时也为药品生产企业在设计过程中提供了极具价值的参考蓝图。
面对这一全新且严格的规范,药品生产企业的验证管理员们面临着新的挑战与机遇。他们如何在生物医药厂房设计过程中,确保符合GMP合规要求,成为当前亟待解决的问题。
一、GMP对生物制品的厂房要求

二、生物制药厂房设计GMP合规要点
为降低污染和交叉污染风险,需根据药品特性、工艺流程及洁净度级别合理设计厂房、设施和设备,并鼓励采用先进制造技术。设计需符合防火安全规定及国家环保标准,确保安全并减少环境污染。同时,应考虑节能减排,满足交通、物流等规范,并安装信息化系统。设计前应进行风险评估,关注物料、工艺、人流物流、生产规模等因素。仓储区设计需防差错,质量控制区应独立或与生产区分区设置。生产辅助区应分区布置,避免对生产造成污染,辅助区设置不应影响关键区域。生物制药厂房设计GMP合规要点如下表:

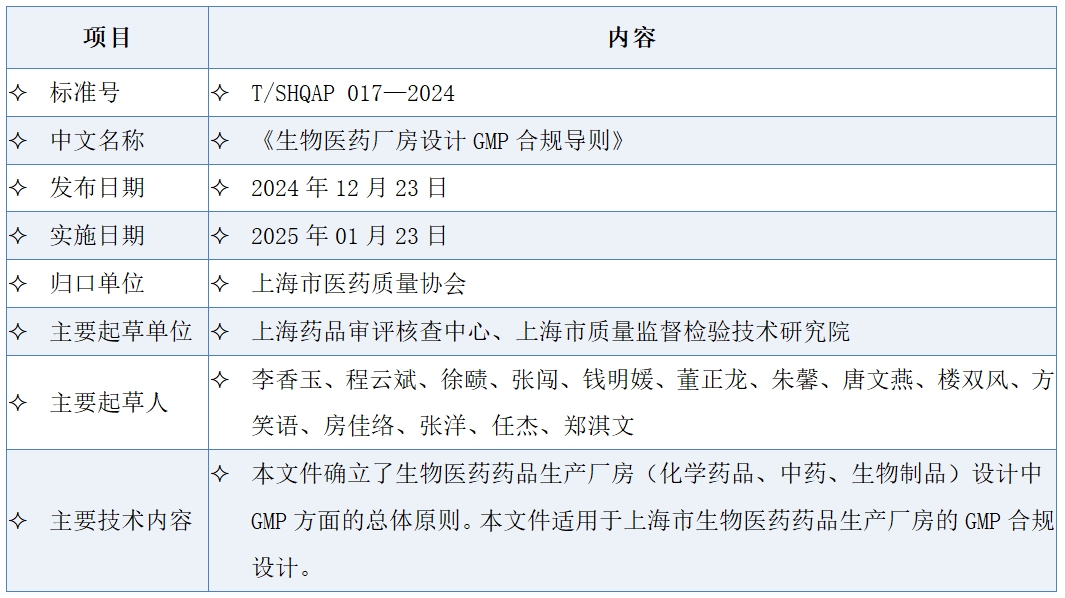
三、《生物医药厂房设计GMP合规导则》标准信息
参考文献
[1] www.ttbz.org.cn等



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57