国家药监局于2021年5月28日颁布的《药品检查管理办法(试行)》,标志着我国药品监管体系与国际接轨的重要一步。该办法要求各省级药监部门结合实际情况制定具体的实施细则。紧随其后,北京市药监局于2024年12月19日在官网发布了《北京市药品检查管理办法生产环节实施细则(试行)》的通知,宣布这一新的管理办法将立即生效。这一新政策的实施,旨在贯彻落实国家层面的药品检查管理办法,进一步规范北京市药品生产检查行为,提升药品生产监管能力,确保公众用药安全,并推动医药产业的高质量发展。依据相关法律法规和规范性文件,该细则的出台旨在规范药品检查行为,促进药品监管工作迅速适应当前的新形势。
对于制药企业而言,新的《北京市药品检查管理办法生产环节实施细则(试行)》不仅是监管要求的体现,更是企业面临的挑战与机遇并存的新时代。这一办法的发布将直接影响企业的运营和发展。只有深刻理解法规背后的要求细则,明确药品上市后的监管原则、流程和趋势,企业才能在新法规的引领下找到正确的发展方向,实现高效合规运营。
为了帮助制药企业更好地理解和应对这一新政,本文为大家梳理了新政下药品生产环节实施细则的核心实施要点并结合自己的解读与大家分享。
一、中国NMPA正式申请加入PIC/S,省级药监部门准备好了吗?
中国正积极寻求加入药品检查合作计划(PIC/S),旨在推动药品监管体系国际化。PIC/S作为全球药品GMP检查的权威国际组织,致力于统一检查标准,加强国际合作。其GMP规范代表着国际高水平的药品生产质量管理标准。
自2017年起,中国便开始筹备加入PIC/S的相关工作。2023年9月下旬,国家药品监督管理局(NMPA)正式提交加入申请,并于11月获得正式申请者身份,这标志着中国药品制造业在国际化道路上取得了显著进展。
加入PIC/S将涉及对中国药品监管检查体系及质量管理体系的全面评估。评估过程将涵盖法规、GMP标准、检查程序等多个方面,通过11个模块及其下的亚指标进行细致考察。这有助于中国完善药品监管体系,提升GMP检查工作水平,实现与国际接轨和互认。
表1 PIC/S审计清单概要
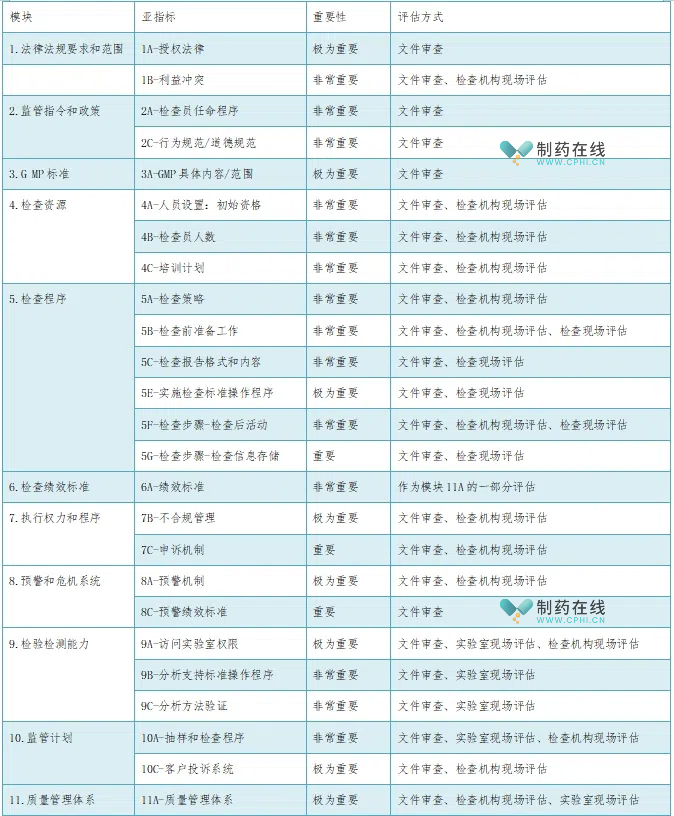
来源:《中国新药杂志》
然而,我国地域辽阔,各省级药监部门在检查工作中存在差异,与PIC/S的要求也存在一定差距。因此,在执行过程中可能会遇到非客观因素较多、尺度不统一等问题。为确保顺利加入PIC/S并满足其要求,各省级药监部门需要积极准备,提升自身检查能力和水平,以形成自上而下、高质量且国际化的药品监管体系。
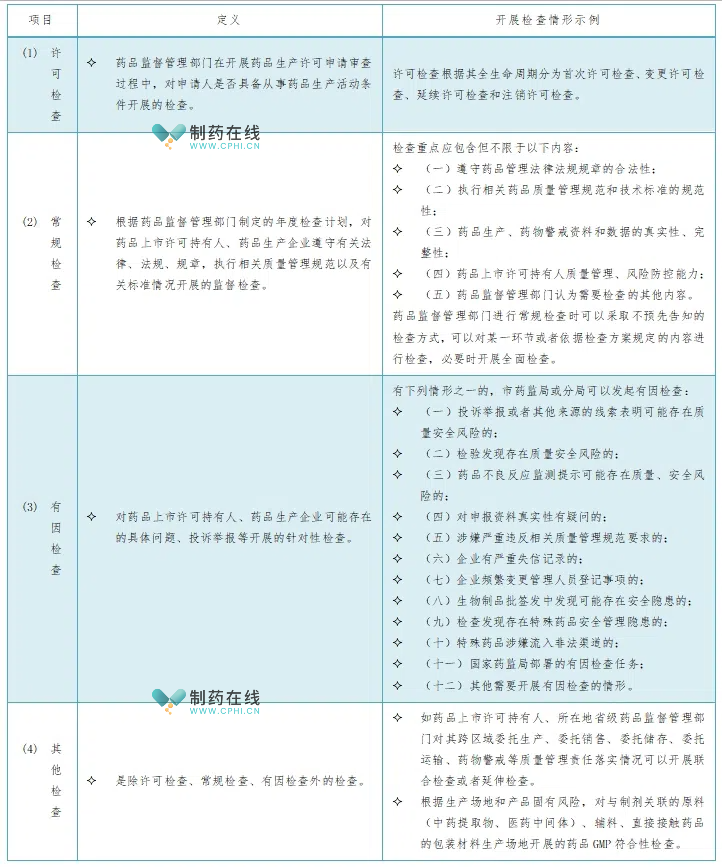
二、我国药品生产环节的检查分类概览
北京市新出台的《药品检查管理办法生产环节实施细则(试行)》旨在完善药品生产质量管理体系,提升监管能力,响应国家药监局加入PIC/S的布局。PIC/S GMP作为国际通行的药品生产质量管理规范与理念,代表着高水平的质量管理标准。在药品上市后监管体系中,药品检查是确保药品安全性和有效性的关键环节。针对不同特性和风险等级的药品,监管机构会实施定期或不定期的检查。根据检查性质和目的,药品生产环节检查分为许可检查、常规检查、有因检查、其他检查,涵盖了从许可审查到常规监管、再到有因调查和专项应对的全方位、多层次监管体系。这一体系旨在通过科学、严谨的检查手段,确保药品质量可控、安全有效,保障公众用药安全,定义和开展检查情形摘录如下表:
参考文献
[1]www.nmpa.gov.cn、北京市药监局、PIC/S、《中国新药杂志》等官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57