在喜迎祖国70周年国庆期间,各大朋友圈、网络平台被一则"国家药品监督管理局官网发布公开征求《药品生产监督管理办法(修订草案征求意见稿)》、《药品注册管理办法(修订草案征求意见稿)》、《药品经营监督管理办法(征求意见稿)》意见"的消息疯狂刷屏,备受药界人士的关注,这是历时15年之后的一次全面大修,新版《药品生产监督管理办法》共七章74条,体现了"四个最严"**,坚持重典治乱,去疴除弊,强化以人民健康为中心,坚持风险管理、全程管控、社会共治的原则,代表着一个监管"新时代"的开启。
一、《药品生产监督管理办法》前世今生
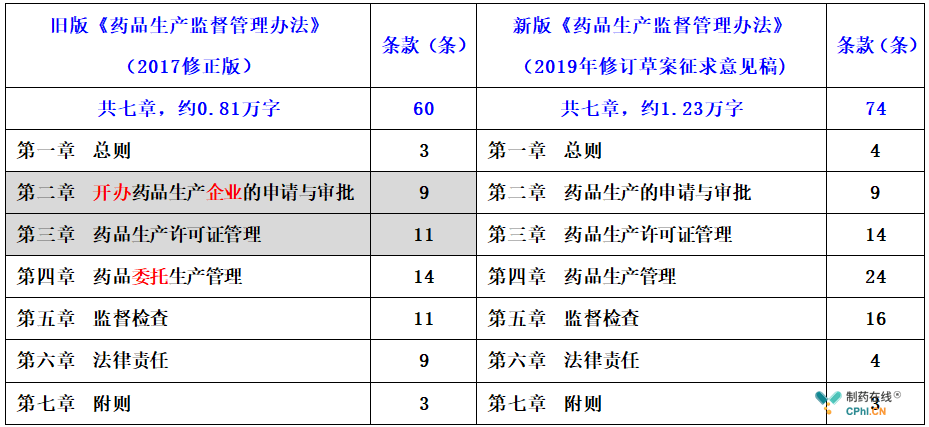
2019年4月,国家药监局正式启动《药品生产监督管理办法》的修订工作,组建起草专班,明确任务倒排工期,加快工作推进,从2003年首次立法到2004年第一次修订间隔了1年,而时隔15年之后,我们将迎来《药品生产监督管理办法》的第二次重大修订。新版《药品生产监督管理办法》(2019年修订草案征求意见稿)相比于旧版《药品生产监督管理办法》(2017修正版),字数从7章60条约0.81万字增加至7章74条约1.23万字,对照如下。
新旧版《药品生产监督管理办法》章节对照表
二、新版《药品生产监督管理办法》主要内容抢先看
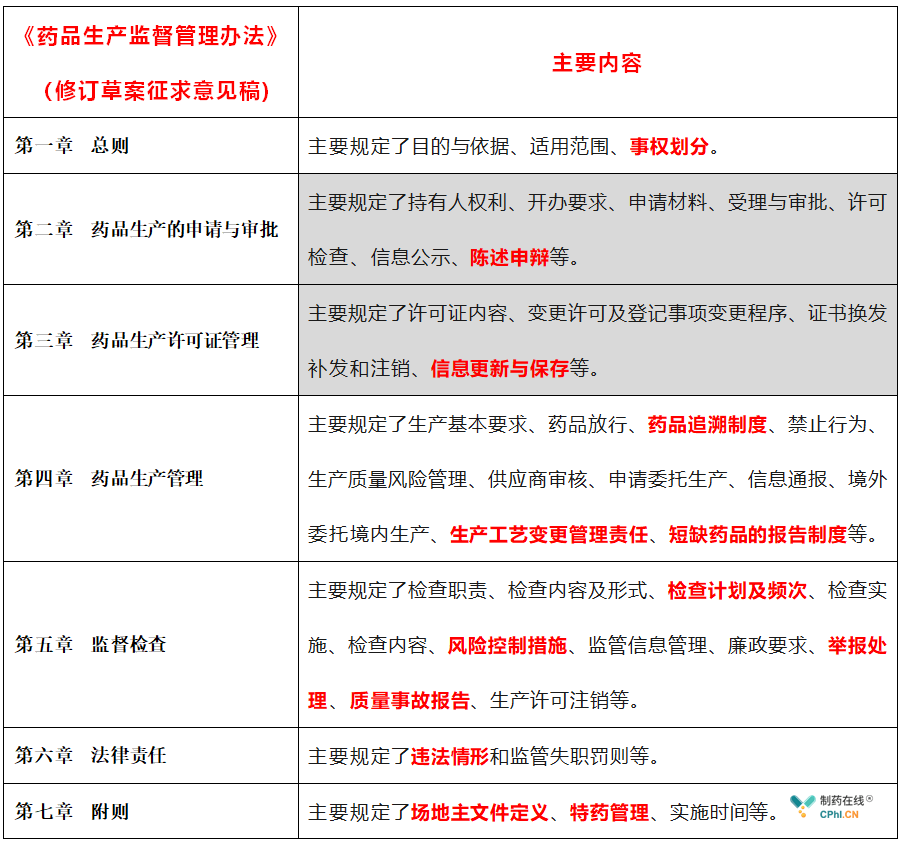
本次《药品生产监督管理办法》修订工作坚决落实"四个最严"要求,全面贯彻新修订《药品管理法》,在修订过程中,注重对标国际先进经验,研究了美国、欧盟、日本等国家和地区药品生产监管情况,结合国内实际,突出问题导向,深入研究当前我国药品生产环节监管工作实际,尽可能使《药品生产监督管理办法》具有良好的操作性,更好满足药品生产监督管理需要,新版《药品生产监督管理办法》七章74条主要内容如下:
三、新版《药品生产监督管理办法》关键点抢先看
3.1 如何做好监督检查工作

3.2 取消GMP认证 实施"两证合一"

3.3 注册和生产许可衔接重大调整

3.4 大胆"放权" 决不"放手"

参考文献
[1] www.nmpa.gov.cn/WS04/CL2138/359096.html?from=timeline&isappinstalled=0
[2] www.nmpa.gov.cn/WS04/CL2174/300701.html
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57