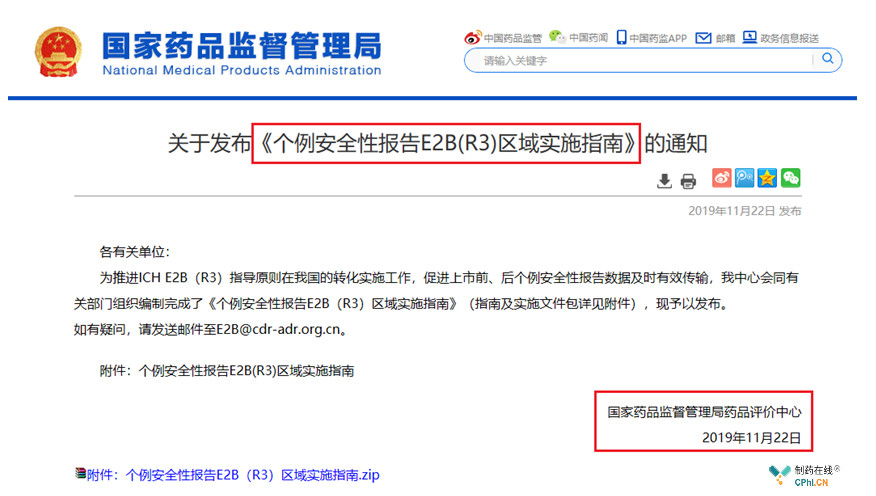
2019年11月22日,各大朋友圈、网络平台被一则"国家药监局药品评价中心发布了《个例安全性报告E2B(R3)区域实施指南》的通知"的消息疯狂刷屏,让我们再次看到了国家药监局加速与ICH接轨的决心与行动,本文为大家梳理了个例安全性报告规范(ICH E2B(R3))相关知识点。
一、国际如何布局实施ICH E2B
国际人用药品注册技术协调会(简称ICH),作为药品领域极其重要的国际组织,主要是协调各国的药品注册技术要求,使药品生产厂家能够应用统一的注册资料,提高新药研发、注册、上市的效率,个例安全性报告是目前发现药品不良反应信号的主要来源之一,如果没有一个统一的标准,个例安全性报告将会五花八门,杂乱无章,ICH详细规范了临床安全性数据管理细则ICH E2B,以期指导不同国家个体病案安全性报告规范。
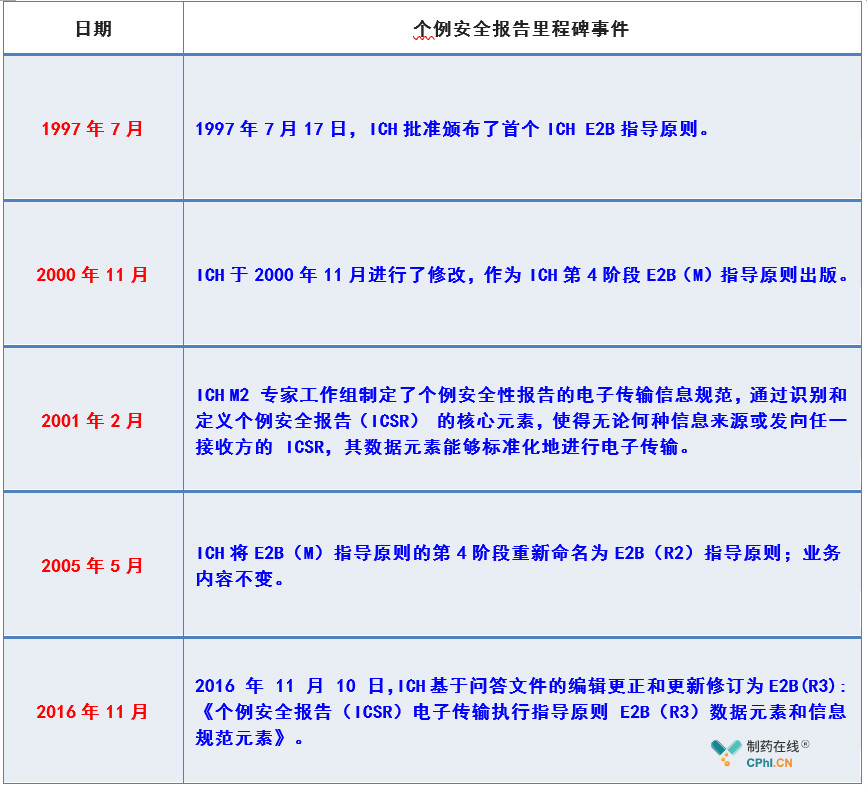
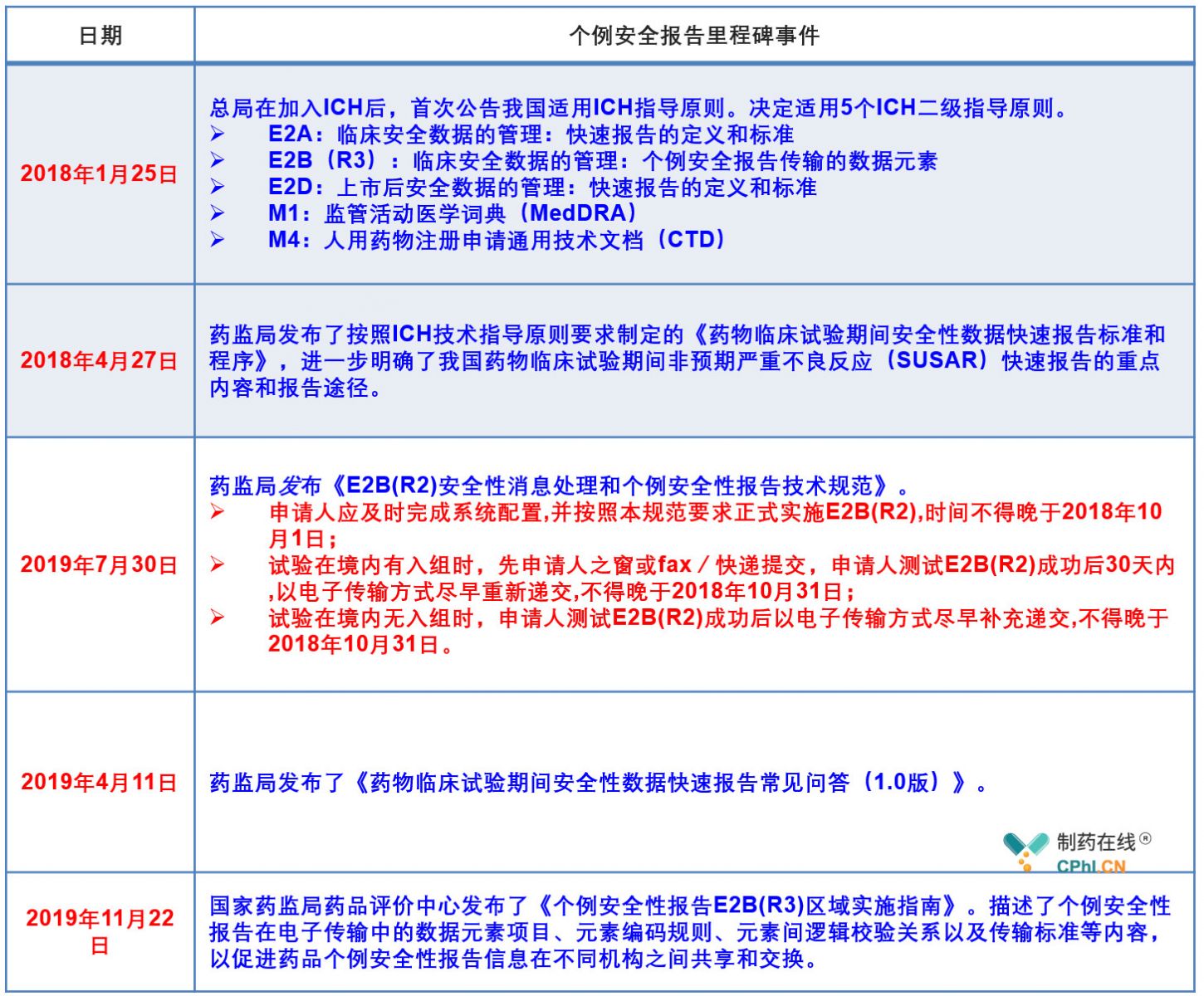
二、中国如何布局实施ICH E2B
自2017年6月国家药品监督管理局(NMPA)正式加入国际人用药品注册技术协调会(ICH),成为全球第8个监管机构成员以来,有序布局实施ICH E2B(R3)相关通知和规范,以最大程度保障临床安全。
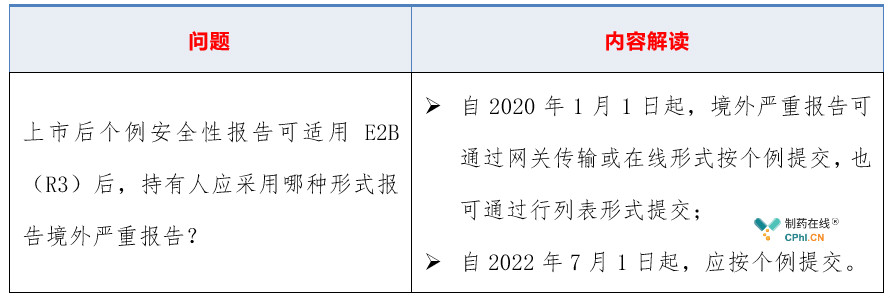
三、《个例安全性报告E2B(R3)区域实施指南》常见问答
2019年11月22日,国家药监局药品评价中心同步发布了《个例安全性报告E2B(R3)区域实施指南问答文件》,是对实施指南内容的补充,常见问题和解读如下:
2.1 采用哪种形式报告境外严重报告?
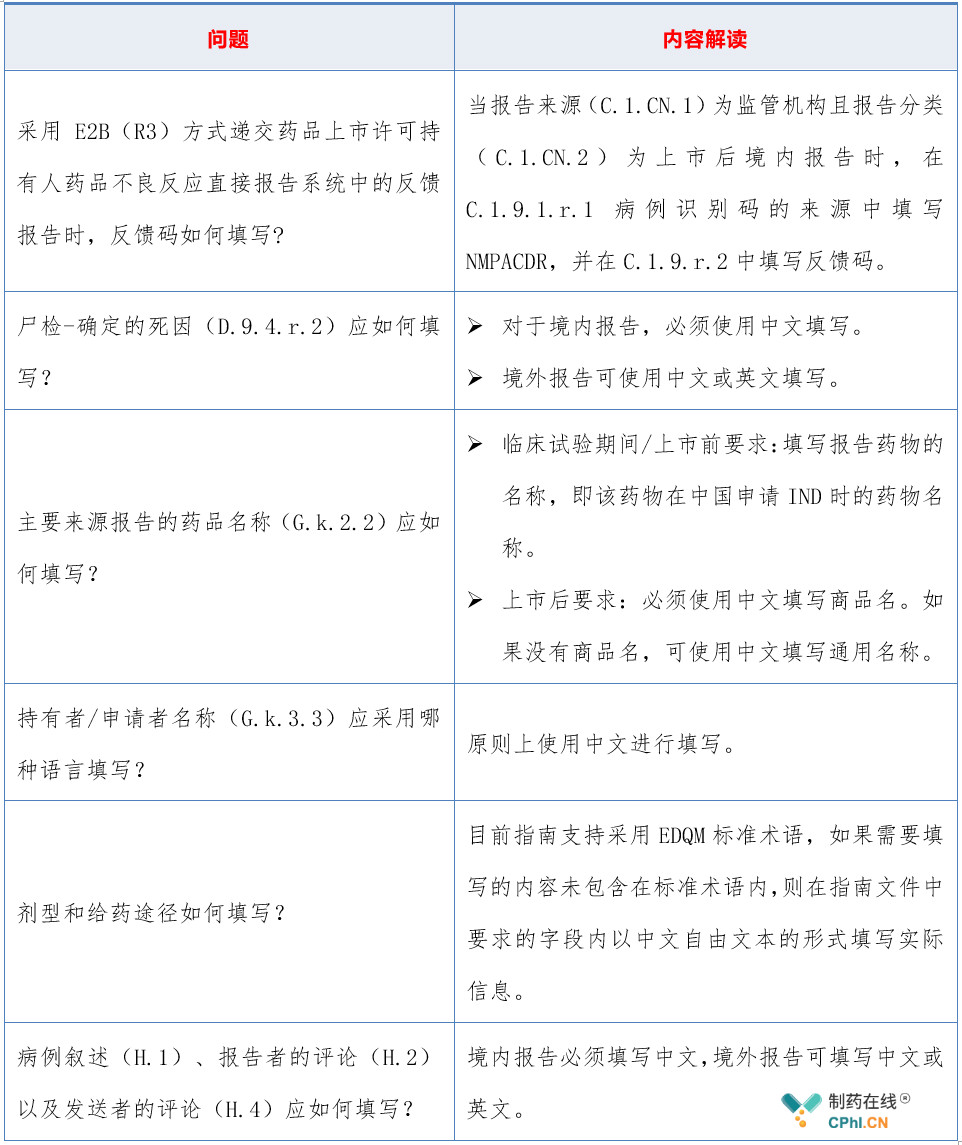
2.2 如何填写个例安全性报告?
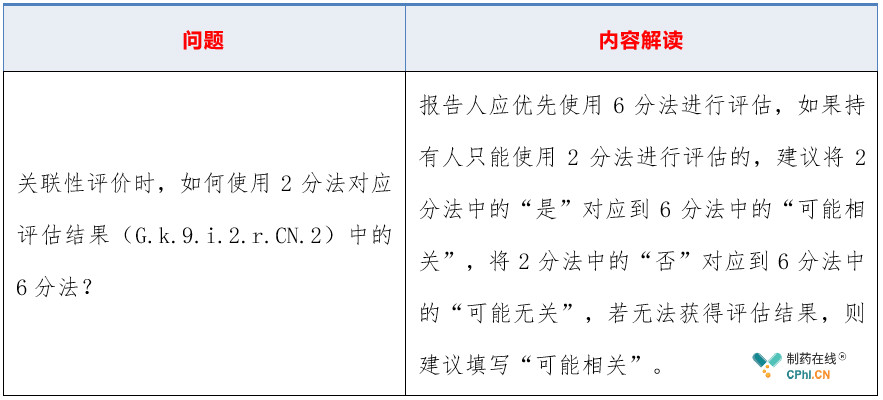
2.3 关联性如何评价?
2.4 如何配置?如何处理传输异常?

参考文献:
[1] www.nmpa.gov.cn/WS04/CL2199/371413.html
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57