2020年01月08日,为更好地指导企业进行仿制药的开发,降低研发成本,提高研发效率,对标国际先进标准,国家药品监督管理局药品审评中心官网发布关于公开征求"对我国《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》中关于多规格豁免BE药学评价标准"处方比例相似性"相关问题的问答"意见的通知,征求意见时效为1个月,对口服固体制剂行业具有深远的意义,为口服固体制剂多规格豁免BE药学评价标准"处方比例相似性"相关问题指明方向,本文对免BE药学评价标准"处方比例相似性"相关相关政策法规进行了分析。
一、生物等效性(BE)为何物?
原国家食品药品监督管理总局于2016年3月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,该指导原则提出生物等效性(Bioequivalence,BE)的定义:是指在相似的试验条件下单次或多次给予相同剂量的试验药物后,受试制剂中药物的吸收速度和吸收程度与参比制剂的差异在可接受范围内。生物等效性研究方法按照研究方法评价效力,其优先顺序为药代动力学研究、药效动力学研究、临床研究和体外研究。
二、BE药学评价方法有哪些?
2016年3月发布了《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》提出:对于多规格口服固体制剂(如,常释制剂:片剂和胶囊,调释制剂:肠溶片、缓释片剂、缓释胶囊等),可以基于其中某一规格(通常建议为最高规格)的人体生物等效性试验结果,采用体外药学评价的方法豁免其他规格人体生物等效性研究。药学评价方法包括:
1)各规格制剂在不同pH介质中体外溶出曲线相似;
2)各规格制剂的处方比例相似。
三、处方比例相似有哪些类型?
1. 不同规格之间所有活性和非活性组分组成比例相似。
2. 对于高活性的药物(原料药在制剂中所占重量比例低):
2.1不同规格的制剂重量一致(差异不超过10%);
2.2各规格使用相同的非活性组分;
2.3规格的变更系通过改变活性组分的用量以及一个或多个非活性组分的用量来实现。
四、"处方比例相似性"相关问题有哪些亮点?
为更好的指导企业进行仿制药的开发,降低研发成本,提高研发效率,国家药品监督管理局药品审评中心组织相关专家对"处方比例相似性"的相关问题进行解读。

五、"处方比例相似性"相关问题有哪些案例可以参考?
(1)案例1:普通片剂-与BE规格的所有活性和非活性组分组成比例完全相同
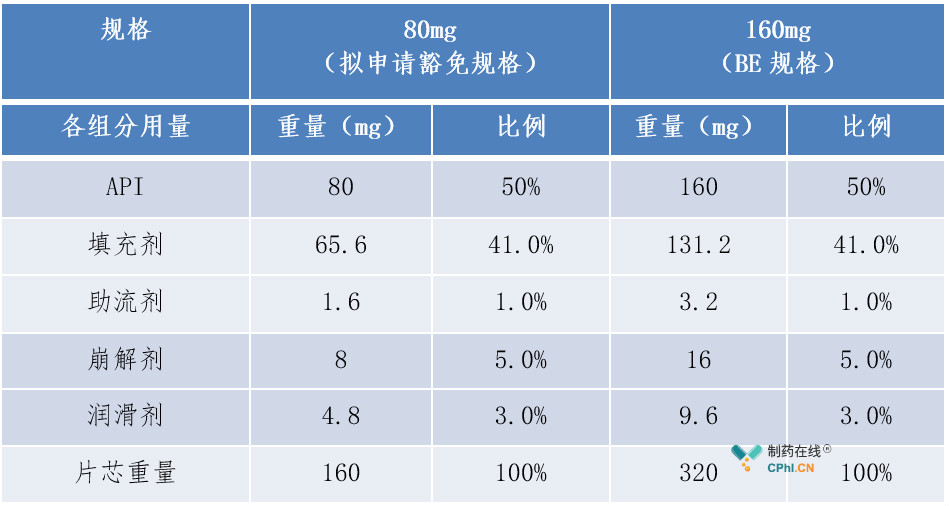
例1中160mg规格为BE规格,拟申请豁免的80mg规格与BE规格的所有活性和非活性组分组成比例完全相同,符合"组成比例相似"的第一种情形,结合BE规格制剂符合生物等效性要求,且各规格制剂在不同pH介质中体外溶出曲线相似的前提条件,可以豁免80mg规格的BE试验。
(2)案例2:普通片剂-不同规格之间所有活性和非活性组分组成比例完全相同
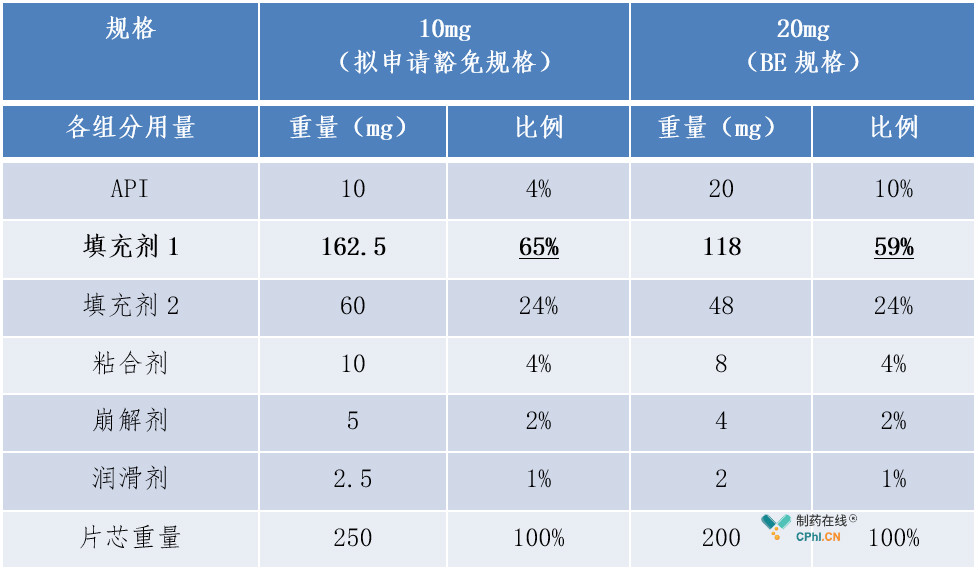
例2中20mg规格为BE规格。首先,拟申请豁免的10mg规格与BE规格相比,不是所有活性和非活性组分组成比例相同,故不属于"不同规格之间所有活性和非活性组分组成比例完全相同"的情形。其次,本品所有规格不属于"高活性药物",且10mg规格与BE规格的处方中唯一比例不同的填充剂比例变化幅度为59%-65%=6%,小于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%)内,故10mg规格符合"组成比例相似"的第二种情形,可以豁免BE试验。
(3)案例3:缓释制剂-不同规格之间所有活性和非活性组分组成比例完全相同
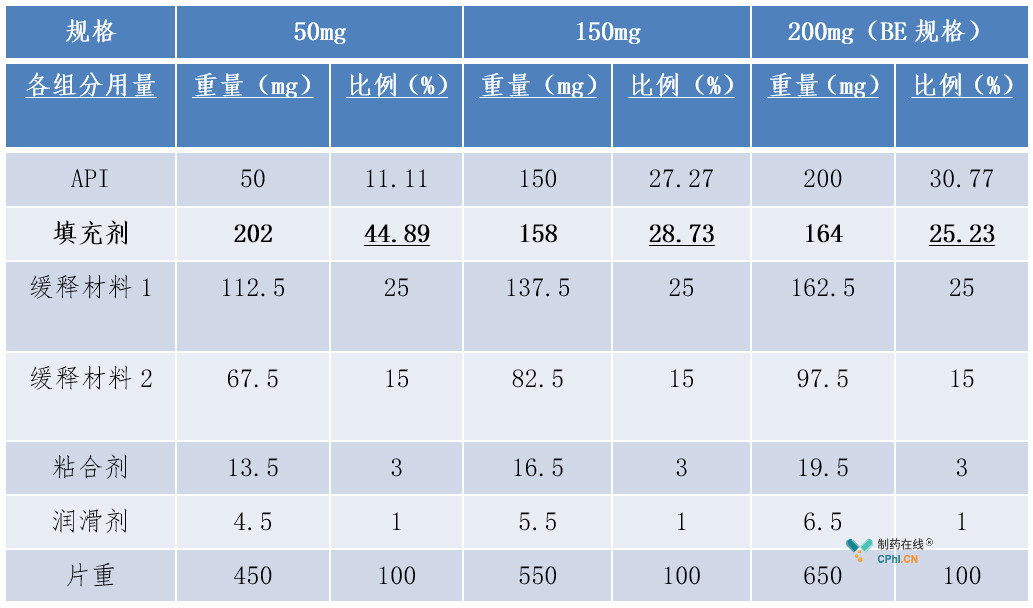
例3中200mg规格为BE规格。判断其他规格与BE规格的"组成比例相似性"时,首先发现其他规格与BE规格相比,不是所有活性和非活性组分组成比例相同,故不属于"不同规格之间所有活性和非活性组分组成比例完全相同"的情形。其次,150mg与BE规格的处方中唯一比例不同的填充剂(非释药控制性辅料)比例变化幅度为28.73%-25.23%=3.5%,小于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%)内,故150mg规格符合"组成比例相似"的第二种情形,可以豁免BE试验;而50mg与BE规格的处方中唯一比例不同的填充剂(非释药控制性辅料)比例变化幅度为44.89%-25.23%=19.66%,大于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%),故50mg规格不符合"组成比例相似"的第二种情形,且也不符合"高活性药物"的相关要求,不可以豁免BE试验。
(4)案例4:缓释制剂-不同规格之间所有活性和非活性组分组成比例完全相同
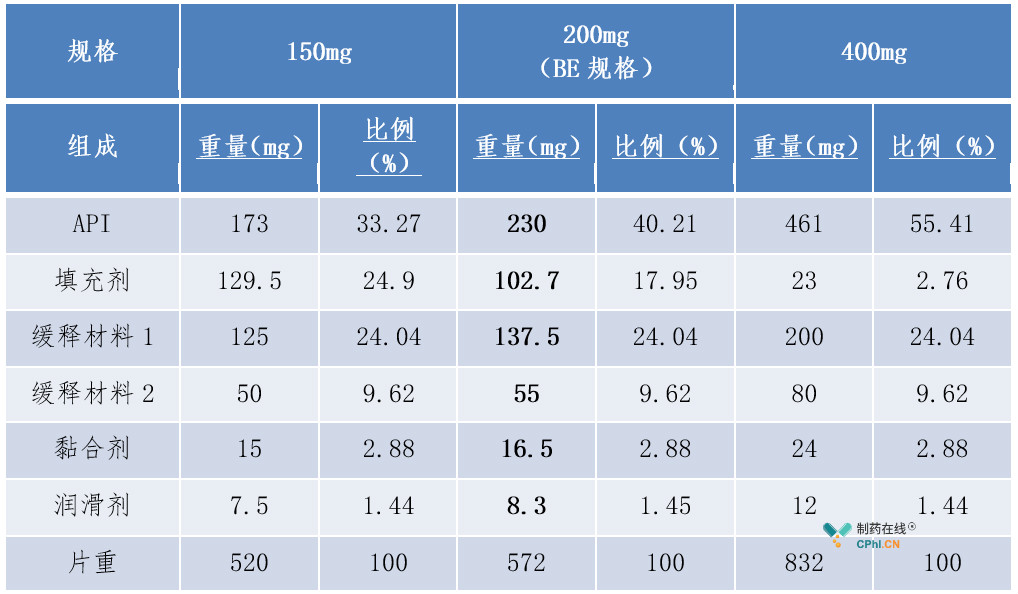
例4中200mg规格为BE规格。判断其他规格与BE规格的"组成比例相似性"时,首先发现其他规格与BE规格相比,不是所有活性和非活性组分组成比例相同,故不属于"不同规格之间所有活性和非活性组分组成比例完全相同"的情形。其次,150mg与BE规格的处方中比例不同的非释药控制性辅料比例变化幅度为(24.9%-17.95%)+(1.45%-1.44%)=6.96%,小于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%)内,且释药控制性辅料的比例均无变化,故150mg规格符合"组成比例相似"的第二种情形,可以豁免BE试验;而400mg与BE规格的处方中比例不同的非释药控制性辅料的比例变化幅度为(17.95%-2.76%)+(1.45%-1.44%)=15.20%,大于《已上市化学药品变更研究的技术指导原则(一)》辅料用量变更中的Ⅱ类变更允许的范围(±10%),故400mg规格不符合"组成比例相似"的第二种情形,且也不符合"高活性药物"的相关要求,不可以豁免BE试验。
参考文献
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=315003
[2] www.cde.org.cn/zdyz.do?method=largePage&id=227
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。
点击下图进行CPhI & P-MEC China 2020观众预登记,立省100元观展门票!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57