
2020年7月6日,国家药品监督管理局药品审评中心官网发布了关于公开征求《药品生产工艺、质量标准及说明书的通用格式和撰写指南(征求意见稿)》意见的通知,会稿截止日期2020年7月20日,广受医药各界关注,本文对新旧版化学药品和治疗用生物制品说明书通用格式主要新增修订内容进行了对比分析。
一、新旧版《化学药品和治疗用生物制品说明书通用格式》对照表
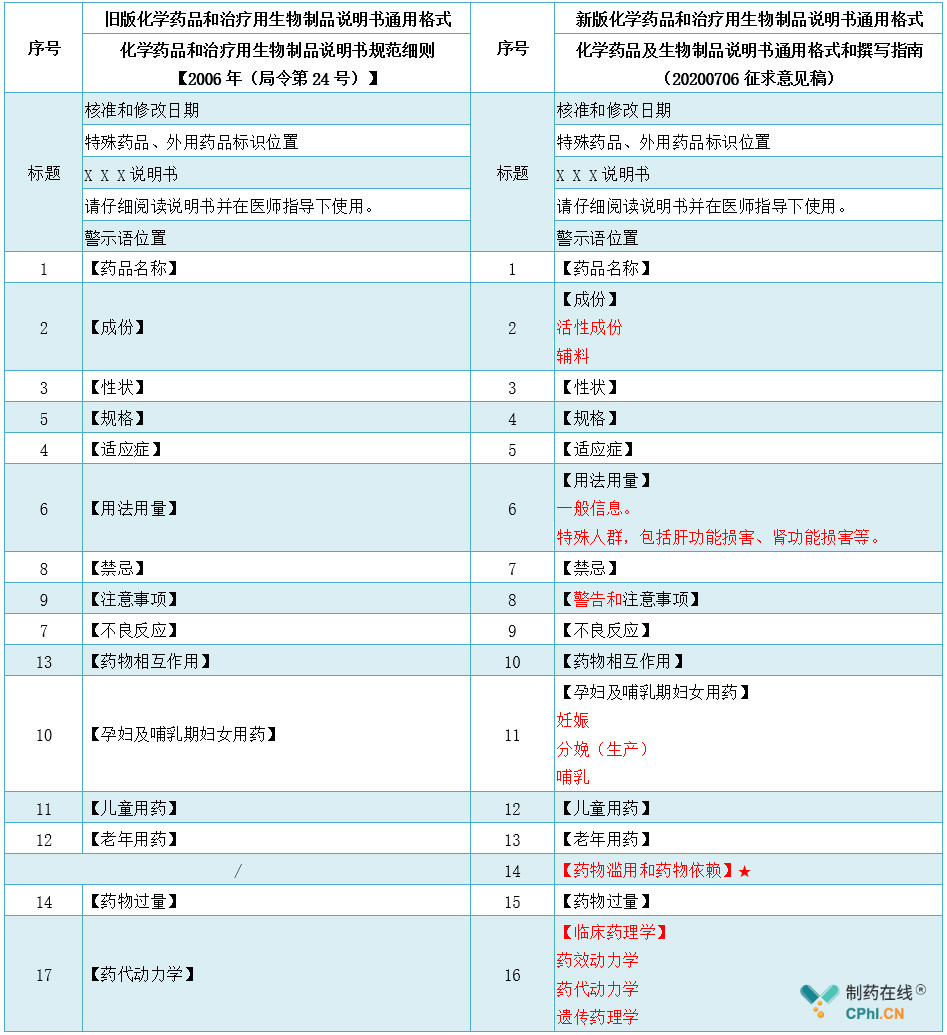
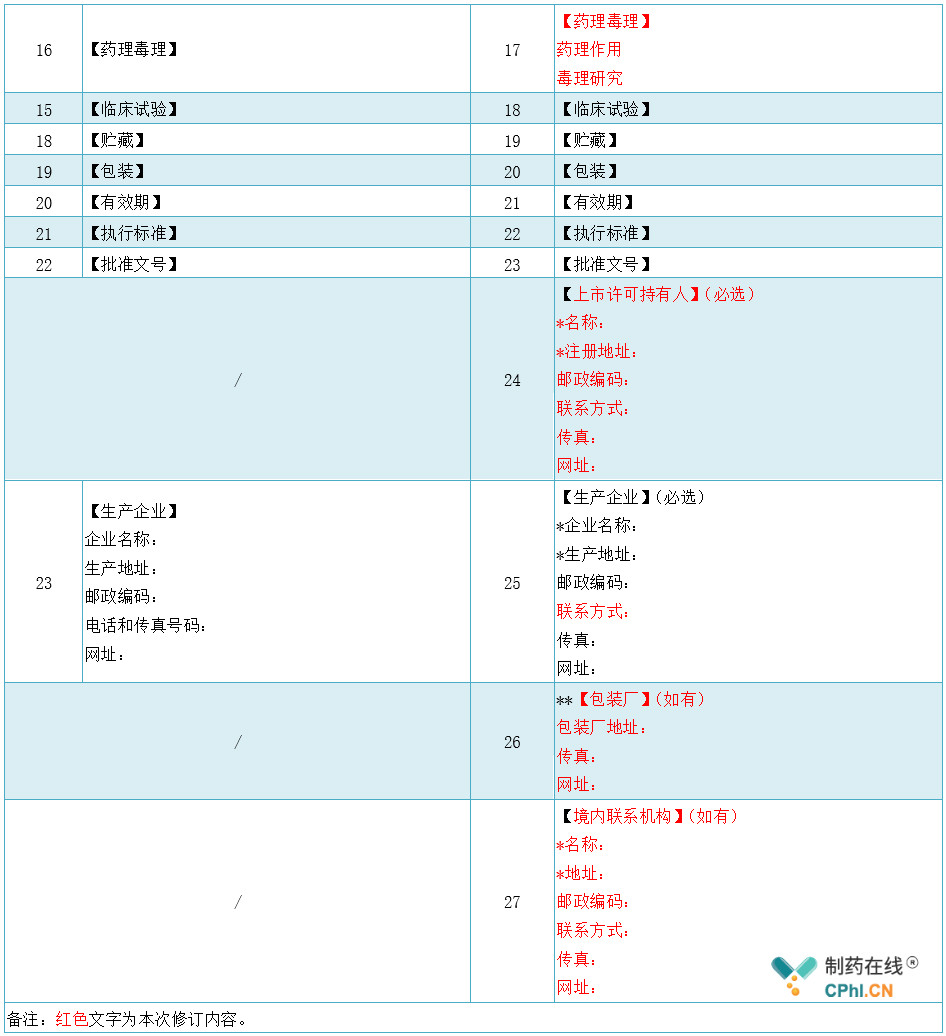
二、新版《化学药品和治疗用生物制品说明书通用格式》变更内容解读
1、【成份】
明确了【成份】项内容为活性成份和辅料,【成份】一般需要考虑以下内容:
(1) 活性成份:治疗用生物制品,应当列出主要成份名称,简述活性成份来源。
(2) 辅料:处方中含有可能引起严重不良反应的辅料的,该项下应当列出该辅料名称。
注射剂应当列出全部辅料名称。
冻干制品的溶媒。
某单抗说明书格式示例--【成份】

2、【用法用量】
明确【用法用量】项内容包括一般信息和特殊人群,包括肝功能损害、肾功能损害等。【用法用量】应当包括用法和用量两部分。需按疗程用药或者规定用药期限的,必须注明疗程、期限。应当详细列出该药品的用药方法,准确列出用药的剂量、计量方法、用药次数以及疗程期限,并应当特别注意与规格的关系。用法上有特殊要求的,应当按实际情况详细说明。
某单抗说明书格式示例--【用法用量】

3、【警告和注意事项】
将原【注意事项】更改为【警告和注意事项】,以强化警告的内容,旨在加强有关风险管控,保障用药安全。【警告和注意事项】一般需要考虑以下内容:
(1) 必须包括对整个说明书中最有临床意义安全性问题的简要总结,这些信息会影响是否处方给药的决定、为确保安全使用药物对患者进行监测的建议,以及可采取的预防或减轻损害的措施。
(2) 应将每个项风险以警示符号标出,每个风险都需包含完整的信息(例如,风险的识别确认,预防或减轻损害的建议等),应体现最重要的临床安全性担忧,反映安全性风险的性质和严重程度。例如:输液反应:已有严重输液反应的报道。发生严重不良反应时应停止用药; 对于发生较轻反应者,在后续用药时考虑给予预处理。应避免使用含糊不清、不详细的信息(例如谨慎使用)和描述禁忌症的术语(例如"不要使用......")。
(3) 应列出使用时必须注意的问题,包括需要慎用的情况(如肝、肾功能的问题),影响药物疗效的因素(如食物、烟、酒),用药过程中需观察的情况(如过敏反应,定期检查血象、肝功、肾功)及用药对于临床检验的影响等。
(4) 滥用或者药物依赖性内容可以在该项目下列出。
4、【孕妇及哺乳期妇女用药】
明确【孕妇及哺乳期妇女用药】项内容包括妊娠、分娩(生产)、哺乳,【孕妇及哺乳期妇女用药】着重说明该药品对妊娠、分娩及哺乳期母婴的影响,并写明可否应用本品及用药注意事项。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
5、【药物滥用和药物依赖】
增加【药物滥用和药物依赖】项。因为镇痛、**、**药物等有可能导致药物滥用或依赖,增加该内容有助于控制用药。【药物滥用和药物依赖】滥用或者药物依赖性内容可以在【警告和注意事项】下列出。
6、【临床药理学】
增加【临床药理学】项,内容包括药效动力学、药代动力学、遗传药理学的内容。原说明书格式中缺少药效动力学、遗传药理学等内容,导致说明书中长期缺少有关信息,说明书内容不全,不利于临床合理用药。同时,删除原说明书中的【药代动力学】项。【临床药理学】包括药效动力学、药代动力学、遗传药理学相关内容。
(1) 药效动力学(PD)须描述与临床效应或不良事件相关的药物或活性代谢产物的生物化学或生理学效应。该部分应包括关于药物及其代谢产物对PD生物标志物或其它临床相关参数影响的描述。
(2) 如果无相关PD数据或PD效应未知,须说明缺乏该部分信息。
(3) 药物对QT间期的影响也应包括在药效动力学部分。
(4) 药代动力学(PK)应包括药物在体内吸收、分布、代谢和排泄的全过程及其主要的药代动力学参数或特征,以及特殊人群的药代动力学参数或特征。说明药物是否通过乳汁分泌、是否通过胎盘屏障及血脑屏障等。应以人体临床试验结果为主,如缺乏人体临床试验结果,可列出非临床试验的结果,并加以说明。未进行药代动力学研究且无可靠参考文献的,应当在该部分予以说明。
(5) 遗传药理学应包括影响药物体内过程以及治疗相关的基因变异相关数据或信息。
某单抗说明书格式示例--【药代动力学】

7、【药理毒理】
明确【药理毒理】项内容为"药理作用、毒理研究",不再涉及与"临床药理学"有关的内容,【药理毒理】一般需要考虑以下内容:
(1) 药理作用:重点阐述药物与临床适应症相关已明确的药理作用,包括药物类别、作用机制、药理活性等;复方制剂的药理作用可以为每一组成成份的药理作用。如果药物获准用于不同适应症的作用机制不同,需对其用于不同适应症的作用机制进行阐述。如果的作用机制尚不明确,需明确说明。
(2) 对于抗微生物药物,应阐明药物的微生物学特征,包括抗病毒/抗菌活性/药物敏感性、耐药性等。
(3) 毒理研究:与临床应用有关、有助于判断药物临床安全性的非临床毒理研究结果,一般包括遗传**、生殖**、致癌性等特殊毒理学试验信息,必要时包括一般毒理学试验中或其他毒理学试验中提示的需重点关注的信息。应当描述动物种属类型,给药方法(剂量、给药周期、给药途径)和主要**表现等重要信息。复方制剂的毒理研究内容应当尽量包括复方给药的毒理研究结果,若无该信息,应当写入单药的相关毒理内容。若有幼龄动物**研究资料,且已批准药品用于儿科人群,应阐明有关动物**研究内容。
(4) 未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
8、【上市许可持有人】
根据新《药品管理法》及《药品注册管理办法》,增加【上市许可持有人】信息,包括内容:
(1) *名称:
(2) *注册地址:
(3) 邮政编码:
(4) 联系方式:
(5) 传真:
(6) 网址:
*为必填项,其他为选填,如不填写该信息,说明书中删除该项
9、【包装厂】
对于进口药品,根据实际情况可增加【包装厂】信息,同时要求增加【境内联系机构】信息,包装厂与生产厂信息一致的,无需重复填写。并按下列方式列出:
(1) 包装厂地址:
(2) 传真:
(3) 网址:
参考文献
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=433a41fade014896
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57