2020年7月3日,为贯彻落实新《药品管理法》、《药品生产监督管理办法》等法律法规要求,深入推进药品上市许可持有人制度实施工作,释放政策红利,明确药品研制机构的主体责任和监督管理部门的监管责任,山东省药监局官网发布了关于印发《山东省药品研制机构申办药品生产许可证现场检查验收标准(试行)》的通知(鲁药监规〔2020〕1号),自印发之日起施行,有效期2年,这是2019年12月1日起实施史上"最严"的《药品管理法》后国内首部针对研制机构申办药品生产许可证现场检查验收指南,研制机构作为持有人申办许可证属于国家药监局新要求,国家层面未制定出台相关验收标准,此验收标准为国内药品研制机构MAH申办药品生产许可证现场检查提供了法规层面和技术层面的参考,本文对《山东省药品研制机构申办药品生产许可证现场检查验收标准》起草背景及主要内容进行了解读分析。
一、起草背景及制定依据分析
药品上市许可持有人(以下简称MAH)制度的实施是党中央、国务院深化审评审批制度改革,鼓励药品医疗器械创新的重要举措,是我国深化药品监管体制改革的重要组成部分,2015年8月,国务院发布《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号),确定开展MAH制度;2019年12月1日开始施行的修订版《药品管理法》确定在全国范围内实施MAH制度,明确取得药品注册证书的企业或者药品研制机构为持有人,对药品全生命周期的质量安全承担责任;2020年7月1日开始施行的修订版《药品注册管理办法》和《药品生产监督管理办法》等规定进一步明确和细化了MAH制度的框架、适用范围、资质要求和法律责任等内容;国家药监局发布《关于实施新修订<药品生产监督管理办法>有关事项的公告》(2020年第47号),第七条规定以委托生产形式获批为持有人的应在7月1日前申办许可证,但研制机构作为持有人申办许可证属于国家药监局新要求,国家层面未制定出台相关验收标准,山东省药监部门率先在全国开展此项工作,制订了研制机构MAH生产许可检查验收标准。
二、验收标准主要内容抢先看
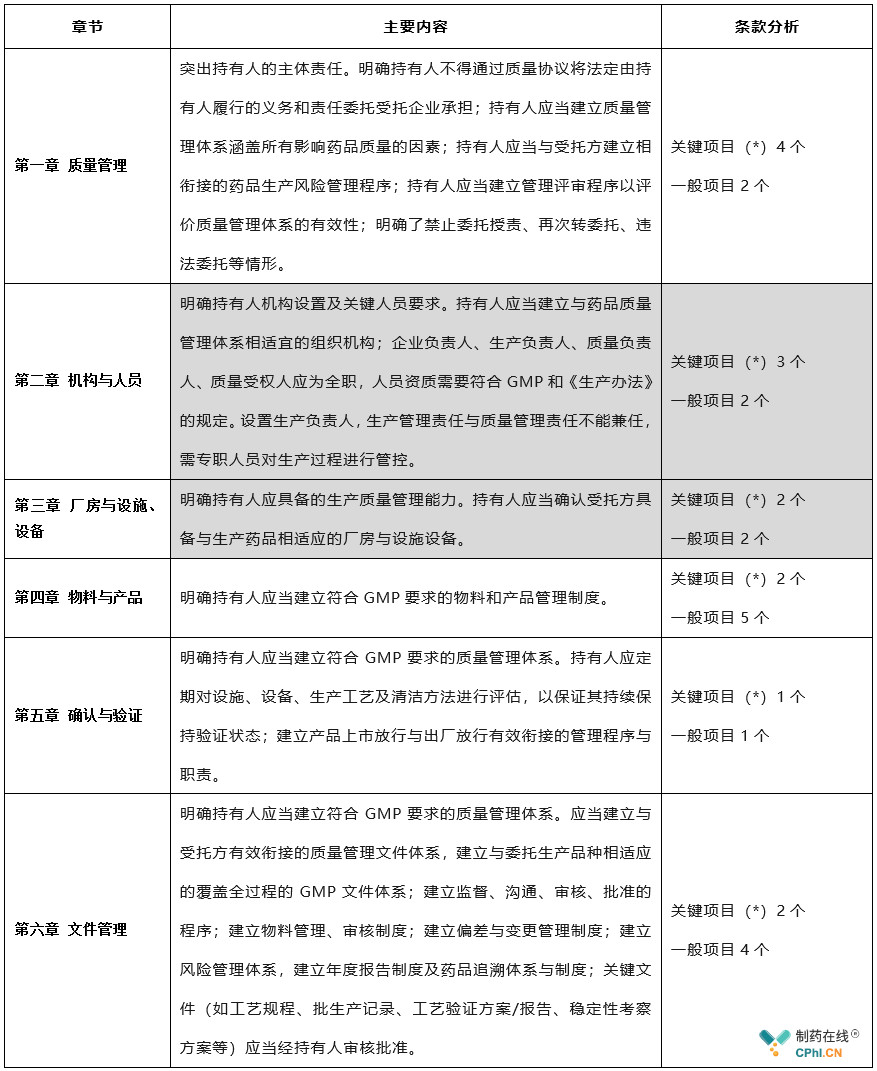
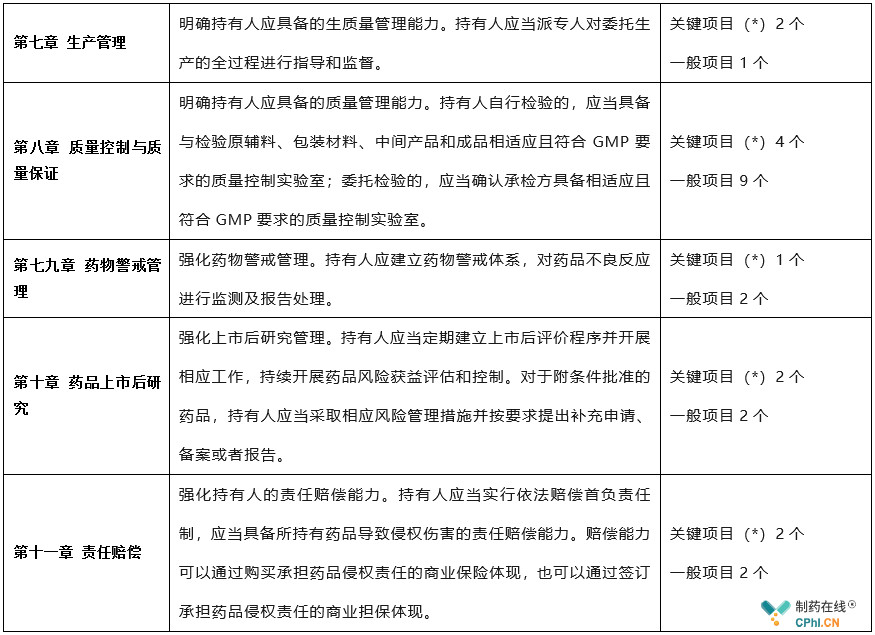
本次修订工作坚决落实"四个最严"要求,坚持以人民健康为中心,坚持风险管理、全程管控、依法科学的原则,明确法律法规要求的持有人各项责任义务,进一步夯实企业主体责任,确保持有人具备保障安全性、有效性和质量可控性的能力,研制机构MAH生产许可检查验收标准共57项,其中关键项目(*)25个,一般项目32个。主要有如下内容及特点:
参考文献:
[1] mpa.shandong.gov.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57