2020年07月31日(星期五),国家药品监督管理局官网发布公开征求《药品上市后变更管理办法(试行)》(征求意见稿)的通知,征求意见截止日期2020年08月15日,这是国内首部专门针对药品上市后变更管理起草的指导性文件,将对我国药品上市后监管工作和规范药品上市许可持有人(以下简称MAH)药品上市后变更行为提供更加系统、可操作性的要求。看到的绝不仅仅是如何开展药品上市后变更管理的具体要求,背后体现出对于药品上市后变更复杂性和新监管时代的科学监管考量,充分体现了加强事中事后监管和放管服的管理理念,充分释放MAH制度红利。本文对药品上市后变更管理痛点和《药品上市后变更管理办法(试行)》(征求意见稿)亮点进行了分析。
一、药品上市后变更管理痛点
药品,关系人民群众生命健康,关系公共卫生安全和国家安全,但近几年以来药品上市后变更,尤其生产工艺变更出现的一些情况,让我们对药品的管理更加关注,2018年长生生物**造假案(随意变更工艺参数和设备"、将不同批次的原液进行勾兑配制,再对勾兑合批后的原液重新编造生产批号、生产药品使用的离心机变更未按规定备案),暴露出部分企业存在变更研究水平及风险控制水平参差不齐、对变更控制和管理的重视不够、开展相关研究不充分等问题,基于上述原因,国家药监局举一反三,堵塞漏洞,本着鼓励持有人持续改进工艺,提高和保障药品质量的目标,2019年12月1日实施的新修订《药品管理法》中单独提出了药品上市后变更管理章节,这是建立药品全生命周期质量控制体系的重要组成部分。
二、《药品上市后变更管理办法(试行)》亮点抢先看
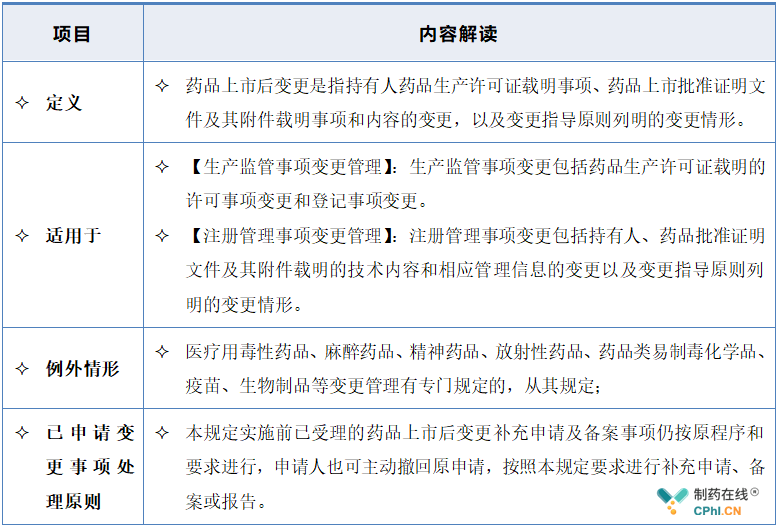
2.1 适用范围
2.2 对标国际标准 变更分类和动态管理更科学
变更是基于科学研究和科学认知开展的,随着生产管理水平和生产技术的不断提升,不同时期同一变更情形的类别的判定也会不同,其风险级别也可能不同,《药品上市后变更管理办法(试行)》立足国内药品上市后变更的发展现状,借鉴发达国家的先进管理理念,结合国内外相关法规和技术要求,本着科学性、可操作性、前瞻性和先进性相结合原则起草,对各变更事项风险评估分级是在基于科学和风险的基础上,按照2020年7月1日实施的《药品注册管理办法》分为三类,分类的过程中参考了WHO、FDA、EMA等发布的相关指导原则,因此原则上对各项变更事项的风险分级与国际共识保持一致,在变更分类原则中,变更管理类别分为重大变更、中等变更和微小变更,分别按照有关规定经批准、备案后实施或报告,持有人对报送资料的真实性、准确性和完整性负责。其中,生产监管事项变更按照《药品生产监督管理办法》的有关规定执行。并明确,MAH可以根据管理和生产技术变化对变更管理类别判定后进行调整,并按照新判定的变更管理类别经批准、备案后实施或者报告,MAH无法确定变更管理类别或拟对指导原则中列明的变更管理情形调整管理类别的,可在充分研究和验证基础上与药品监管部门进行沟通并达成一致后按规定实施,无法达成一致的,由省级药品监管部门转请国家局药审中心协助明确变更管理类别,药审中心应在30日内答复。境外生产药品的变更无法确认变更管理类别的,可在充分研究和验证的基础上与药审中心沟通,具体按照药品注册沟通交流的有关程序进行。
2.3 释放取消技术转让审批制度信号
《药品上市后变更管理办法(试行)》《征求意见稿》最后一条款,即【实施日期】:本规定自发布之日起施行,原国家食品药品监督管理局发布的《关于印发药品技术转让注册管理规定的通知(国食药监注〔2009〕518号)》、《关于做好实施新修订药品生产质量管理规范过程中药品技术转让有关事项的通知》(国食药监注〔2013〕38号)废止,值得MAH特别关注,释放取消技术转让审批制度信号,改为MAH变更,有效释放了MAH制度红利,这将对我国药品技术市场带来一次划时代的变革。
三、展望
目前已出台落地的新版《药品管理法》(2019年修订第31号主席令)和已经执行的2010年版药品GMP及还未落地的《药品上市后变更管理办法(试行)》征求意见稿可以明显的体现出来,国内药监局意识到了药品上市后生产工艺变更控制对风险控制的重要性和必要性,正在积极地通过整个法律法规体系的修正完善以及重构,建立对药品上市后变更进行控制的完善的体系行动,希望《药品上市后变更管理办法(试行)》尽快发布落地实施。
参考文献
[1] www.nmpa.gov.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57