2020年11月5日,国家药品监督管理局再放大招,官网发布《化妆品新原料注册和备案资料规范》征求意见稿,征求意见截止时间2020年11月30日,一石激起千层浪,此规范对化妆品行业具有深远的意义,此次的《化妆品新原料注册和备案资料规范》征求意见稿的发布,为配合《化妆品监督管理条例》(已于2020年6月29日由国务院公布,自2021年1月1日起施行)的实施,规范和指导化妆品新原料注册/备案工作,突破性地提出了化妆品新原料注册和备案的资料规范要求,回应了新政下当前化妆品企业最迫切关心的问题,制订系统、详实的新原料注册/备案资料要求,以指导规范注册人/备案人进行新原料的注册或备案,这是我国化妆品发展史上具有里程碑意义的大事。
一、对标国际标准,注重高风险原料管理
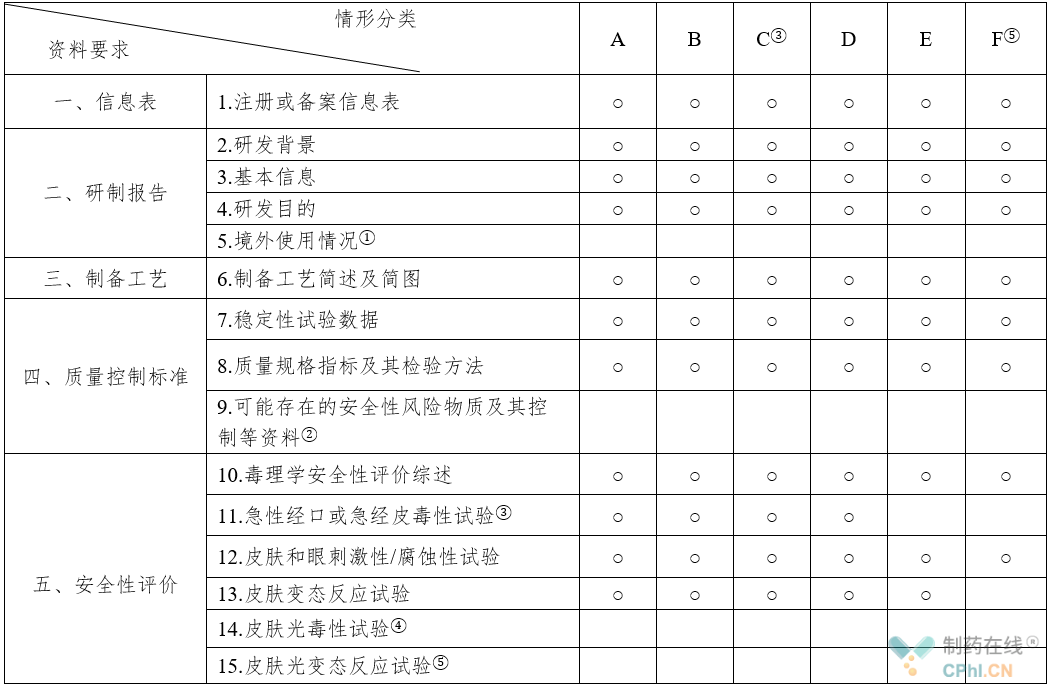
近几年,化妆品行业属于充满活力的朝阳产业,国际社会高度重视化妆品产业发展和化妆品监管,不断推进化妆品监管规则的协调与趋同,中国新版《化妆品监督管理条例》成文时间2020年6月16日,已于2020年6月29日由国务院公布,自2021年1月1日起施行,化妆品的生产过程主要是化妆品原料的配制、填充、灌装的过程,原料管理是化妆品管理的重中之重。新《化妆品监督管理条例》对化妆品原料管理进行专章设计,确定了分类管理、目录管理,已调整为基于风险分类的管理模式,新《条例》第4条第3款规定,化妆品原料分为新原料和已使用的原料。国家对风险程度较高的化妆品新原料实行注册管理,对其他化妆品新原料实行备案管理,但在安全性方面并没有放松要求,因此,本《规范》中对新原料申请注册与办理备案时提交的资料要求是一致的,资料要求根据新原料功效、使用历史等有所不同,新规范暂时划分为A/B/C/D/E/F共六大类:
(1) A类:国内外首次使用的新原料,以及具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、止汗功能的新原料。
(2) B类:具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、止汗功能之外的新原料以及从安全角度考虑不需要列入《化妆品安全技术规范》限用物质表中的化妆品新原料。
(3) C类:具有防腐、防晒、着色、染发、祛斑美白、防脱发、祛痘、抗皱(物理性抗皱除外)、去屑、止汗功能之外的新原料以及从安全角度考虑不需要列入《化妆品安全技术规范》限用物质表中的化妆品新原料,且能够提供充分的证据材料证明该原料在境外上市化妆品中已有三年以上安全使用历史。
(4) D类:具有祛斑美白、抗皱(物理性抗皱除外)、去屑、止汗功能,可提供充分的证据材料证明该原料在境外上市化妆品中已有五年以上安全使用历史的新原料。
(5) E类:能够提供充分证据材料证明具有安全食用历史的化妆品新原料(原料所使用的部位应与食用部位一致)。
(6) F类:化学合成的由一种或一种以上结构单元,通过共价键连接,平均分子量大于1000道尔顿,且分子量小于1000道尔顿的低聚体含量少于10%,结构和性质稳定的聚合物(具有较高生物活性的原料除外)。
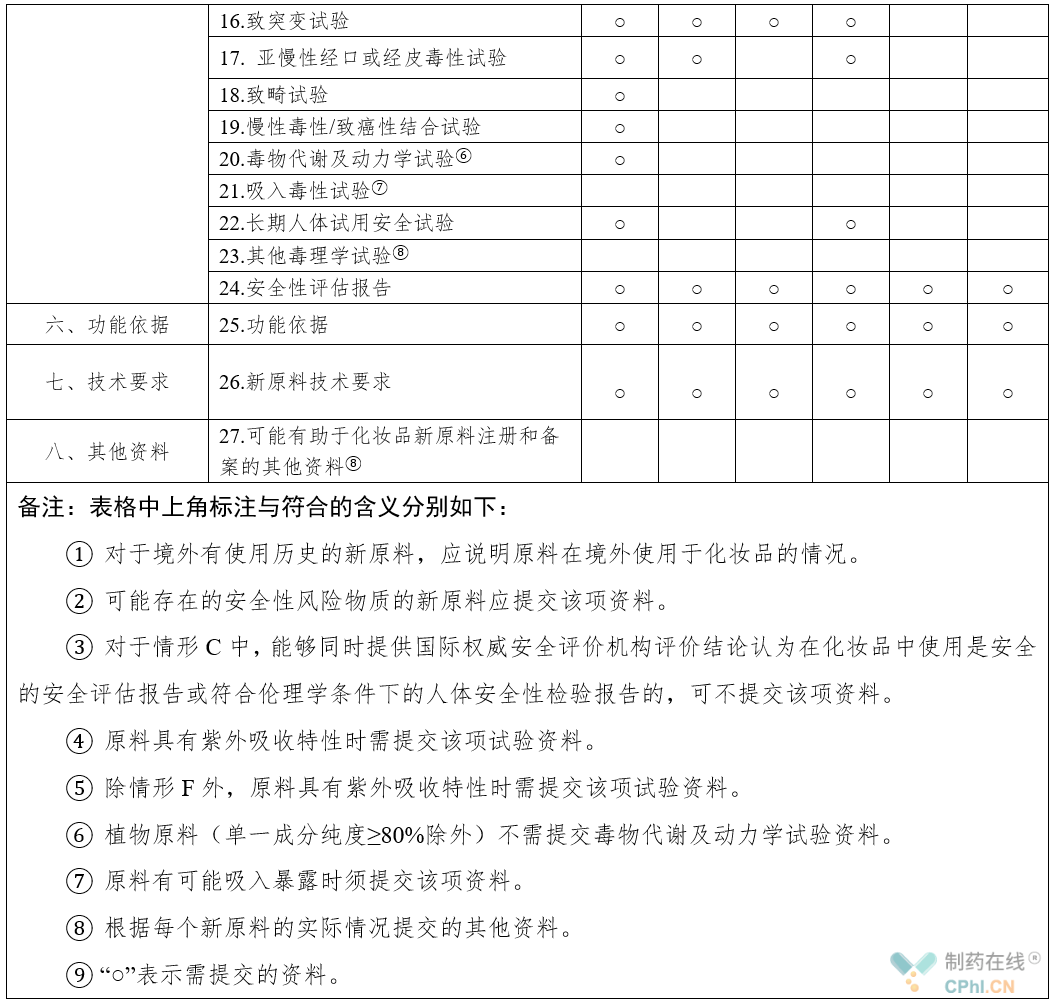
以上六大类新原料化妆品新原料注册和备案资料项目要求如下表所示:
二、与时俱进,新增纳米原料和生物技术来源原料的资料要求
(1)纳米原料:
纳米原料粒径较小,能够穿过生物膜屏障,微量可进入血液,并可能引起细胞DNA损伤和凋亡等特点,欧美等发达国家对纳米原料的安全性非常重视,发布了相关法规或指导文件对纳米原料进行严格监管。新规发布之前我国既未对纳米原料进行定义,也未制订相关管理法规,处于监管盲区。在本《规范》中,参考欧盟法规,给出了纳米原料的定义,并对其理化性质、质量控制标准、安全评价资料等提出了具体资料要求。

(2)生物技术来源原料:
随着现代生命科技的发展,生物技术(包括基因工程、细胞工程、发酵工程、酶工程和蛋白质工程等)来源的原料越来越多,我国现行的《化妆品新原料申报与审评指南》未对该类原料的资料要求及审评原则进行规定,且国外也无相关安全评价标准。鉴于该类原料的风险较高,某些寡肽、多肽等可能具有药品(如生长因子)所属的生物活性,超出了化妆品原料的范畴。因此,本《规范》对生物技术来源原料资料要求比如制备工艺、研制报告、质量控制标准资料等提出了具体资料要求。

参考文献
[1] www.nmpa.gov.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57