
2020年庚子年终于快过去了,从没像今年这样,盼着一个年头快点过去,每个人都经历了不平凡的一年,疫情与灾难交织,悲痛与感动同在,《药物临床试验质量管理规范》(2020年7月1日实施)等多项临床试验政策也频频发布,2020年是广东省药学会药物临床试验专业委员会成立十周年,专委会结合GCP新法规针对医药行业热点难点,更新发布《药物临床试验 制度建设·广东共识(2020年版)》等10个共识,在业内引起广泛关注,对国内药物临床试验机构规范化管理起到了一定的示范和推动作用,本文为大家梳理了药物临床试验的质量管理体系搭建的重点内容并结合自己的解读与大家分享,如有不妥,恳请大家提出宝贵意见。
一、临床试验的质量管理体系法规依据
2020年7月1日起施行的新版《药物临床试验质量管理规范》(2020年第57号)与时俱进地强调开展临床试验所必须的质量管理体系,药物临床试验检查员越来越多地意识到质量管理体系的建立在临床研究中的重要性,新版GCP关于质量管理体系有关描述梳理如下:
(1) 第九条规定:临床试验的质量管理体系应当覆盖临床试验的全过程,重点是受试者保护、试验结果可靠,以及遵守相关法律法规。。
(2) 第三十条规定申办者应当建立临床试验的质量管理体系。申办者的临床试验的质量管理体系应当涵盖临床试验的全过程,包括临床试验的设计、实施、记录、评估、结果报告和文件归档。质量管理包括有效的试验方案设计、收集数据的方法及流程、对于临床试验中做出决策所必须的信息采集;
(3) 第三十一条对的申办者基于风险进行质量管理。
二、建立以质量为核心的GCP质量管理体系
药物临床试验是指任何在人体(患者或健康志愿者)进行药物的系统性研究,以证实或揭示试验药物的作用、药理和(或)其他药效学方面的作用、不良反应及(或)试验药物的吸收、分布代谢和排泄,其目的是确定试验药物的疗效与安全性。药物临床试验是医学临床研究的重要组成部分,也是新药研究开发过程中重要环节,医疗机构必须管理规范、技术过硬,加强过程监督、强化各个环节的质量控制、构建药物临床试验管理体系,方能提高临床研究的质量,以保证药物临床评价的规范性与科学性,科学严谨的GCP质量管理体系为药物的研发提供稳固的地基,许多临床试验相关方尝试在临床试验中采用GMP或ICH Q10(药品生产领域的质量体系)指南,或遵循ISO质量管理体系等,然而,这类标准或指南的适用条件都不是完全适合于临床试验质量体系的建立,目前处于产业变革和政策变革的交叠期,药物临床相关方各方需携手努力,广东省药学会药物临床试验专业委员会结合GCP新法规针对临床试验热点和难点,发布《药物临床试验 制度建设·广东共识(2020年版)》等10个共识,对国内药物临床试验机构规范化管理起到了一定的示范和推动作用,以十项基本措施(制度建设、文档目录、CRC管理、安全评价、监查稽查、伦理审查、受试者隐私保护、药物管理、质量管理、研究团队授权与任务外包)保证临床试验项目质量。
1、流程--制度建设主要内容
不以规矩,不能成方圆。药物临床试验制度是药物临床试验从业人员必须遵守、用以规范药物临床试验行为的规则、条文,是药物临床试验质量的重要保证。制度建设是制定制度、执行制度并在实践中检验和完善制度的动态过程。为了确保药物临床流程执行的一致性,必须制定清晰简洁的程序文件(如管理制度、标准操作程序和岗位职责等)。在涉及多个职能部门的流程中,程序文件的制订最好通过专业团队来共同完成。笔者梳理了《药物临床试验 制度建设·广东共识(2020年版)》常用的制度文件,如下表:

2、文档目录主要内容解读
药物临床试验的资料是体现临床试验全过程的记录,也是评估药物临床试验实施和数据质量的文件,各机构及各伦理委员会对试验资料的要求迥异,试验申办者递交的资料也形式不一,易造成相关资料管理混乱。《药物临床试验 文档目录·广东共识(2020年版)》归纳为以下几类文档目录,向机构办提交的立项资料目录、向伦理委员会提交的初审资料目录、项目实施需保存的资料目录、机构办项目结题需存档的资料目录、伦理委员会项目结题需存档的资料目录,向机构办提交的立项资料目录举例如下:
向机构办提交的立项资料目录举例
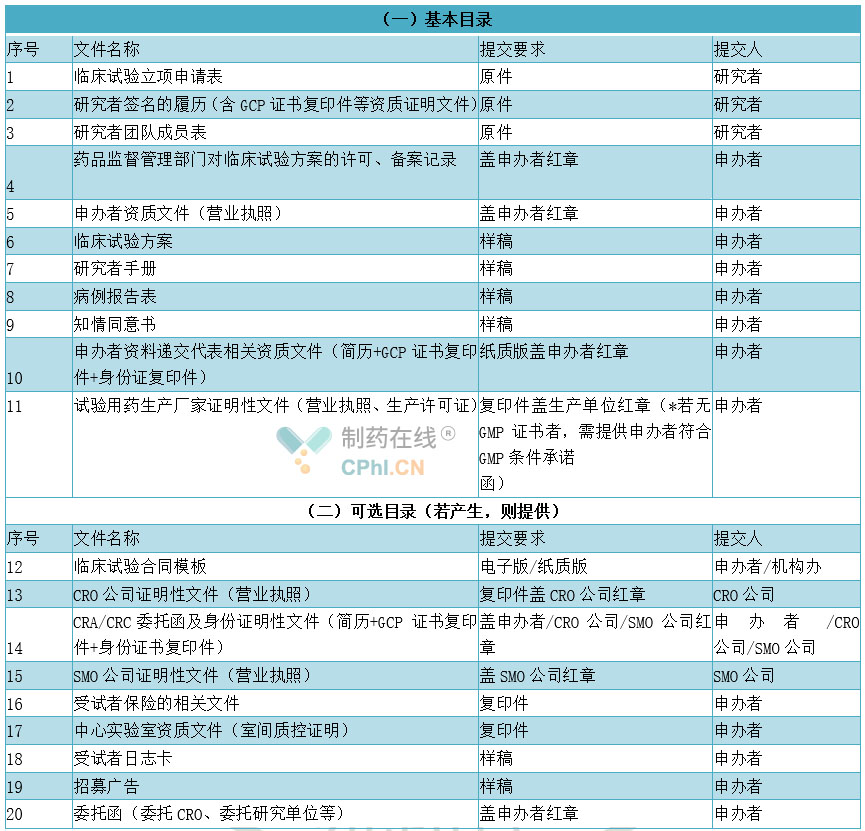
3、CRC管理主要内容解读
CRC(clinical research coordinator,临床研究协调员)作为研究团队一员,是临床试验实施过程的重要参与者,而现行法律法规鲜见关于CRC的明确要求,行业内缺乏统一标准及质量控制,《药物临床试验CRC管理·广东共识(2020年版)》描述了CRC定义、分类、资质与技能、聘用、职责范围、培训''院外CRC使用要点。
4、安全评价主要内容解读
药物临床试验过程中对药物安全性进行评价,是全面、客观评价一个试验药物不可或缺的内容。新版《药物临床试验质量管理规范》(GCP)中,强调了申办者在安全性信息收集、评价、递交和分发环节中的责任,也对研究者如何保障受试者安全、做好安全信息记录和评价提出了更为明确的要求。《药物临床试验 安全评价·广东共识(2020年版)》旨在为研究者进行安全性信息的收集、评价、递交提供指导,为申办者理解研究者的相关工作细节和制定安全信息收集要求提供参考。
5、监查稽查主要内容解读
《药物临床试验 监查稽查·广东共识(2020年版)》描述监查与稽查,作为临床试验过程中质量管理的重要手段,随着我国临床试验监管与时俱进,与ICH-GCP接轨,其实施的具体环节需明确共同遵循的要求及做法,
(1)监查内容包括:监查员资质、监查计划、现场监查访视类型、其他访视类型、监查过程中研究者的义务、现场监查流程等
(2)稽查内容包括:稽查的组织和管理、稽查类别、稽查计划、稽查内容、稽查流程、稽查报告撰写等。
6、伦理审查主要内容解读
《药物临床试验 伦理审查·广东共识》(2020年版)》建议伦理委员会应建立自己的制度,常见制度有:
(1)常用制度:保密制度、利益冲突及回避制度、会议制度、文档管理制度等。
(2)常用SOP∶制定SOP的SOP、培训的SOP、独立顾问选聘的SOP、研究项目受理的SOP、主审审查的SOP、会议审查的SOP、紧急会议审查的SOP、简易审查的SOP、初始审查的SOP、修正案审查的SOP、年度/定期跟踪审查的SOP、安全性信息审查的SOP、违背方案审查的SOP、暂停/终止研究审查的SOP、结题审查的SOP、复审的SOP、审查决定传达的SOP、处理受试者投诉的SOP、实地访查SOP、文档管理及保密的SOP等。
(3)SOP应根据法规要求和工作需要及时更新。
7、受试者隐私保护主要内容解读
《药物临床试验 受试者隐私保护·广东共识(2020年版)》规定受试者权益保护贯穿于药物临床试验的全程,其中受试者隐私保护是容易忽视的环节。药物临床试验过程中对受试者的个人信息进行规范使用和必要保护是试验各方应当遵守的基本准则,是研究者和机构的法定义务,也是公众愿意参与临床试验的前提保证。
8、药物管理安全评价主要内容解读
试验用药品作为整个药物临床试验的核心,其管理贯穿于临床试验全过程,加强试验用药品的管理对保护受试者安全和确保试验结果科学可靠起着至关重要的作用,试验用药品管理是临床试验管理中的关键环节之一,对试验的质量和受试者的安全有举足轻重的作用。《药物临床试验 药物管理·广东共识(2020年更新版)》旨在规范化试验用药品的管理,确保临床试验的安全、有效和质量可控,保障受试者的权益,一般包括接收、贮存、领取/分发、回收和退还/销毁等环节。
9、质量管理主要内容解读
质量是临床试验的核心,临床试验质量管理是一个动态、发展的过程,质量管理是指确定质量方针、目标和职责,并通过质量体系中的质量策划、质量保证、质量控制和质量改进来使其实现所有管理职能的全部活动。《药物临床试验 质量管理·广东共识(2020年版)》建议药物临床试验质量管理应按以下的基本原则推行:
(1)保护受试者的权益和安全是临床试验的基本前提。
(2)临床试验数据的真实、可靠与合规是临床试验质量的核心要素。
(3)严格遵守《中华人民共和国药品管理法》《药品注册管理办法》《药物临床试验质量管理规范》(GCP),以及ICH-GCP等相关法规及要求。
(4)严格执行试验方案和相关制度/标准操作规程(SOP)。
(5)质量是做出来的而不是查出来的:从源头抓起,鼓励第一次就做对。
(6)质量管理体系的构建应符合临床试验特点、行之有效、切实可操作。
(7)打造质量文化,试验各方均应恪守各自的职责,对所承担的工作质量负责
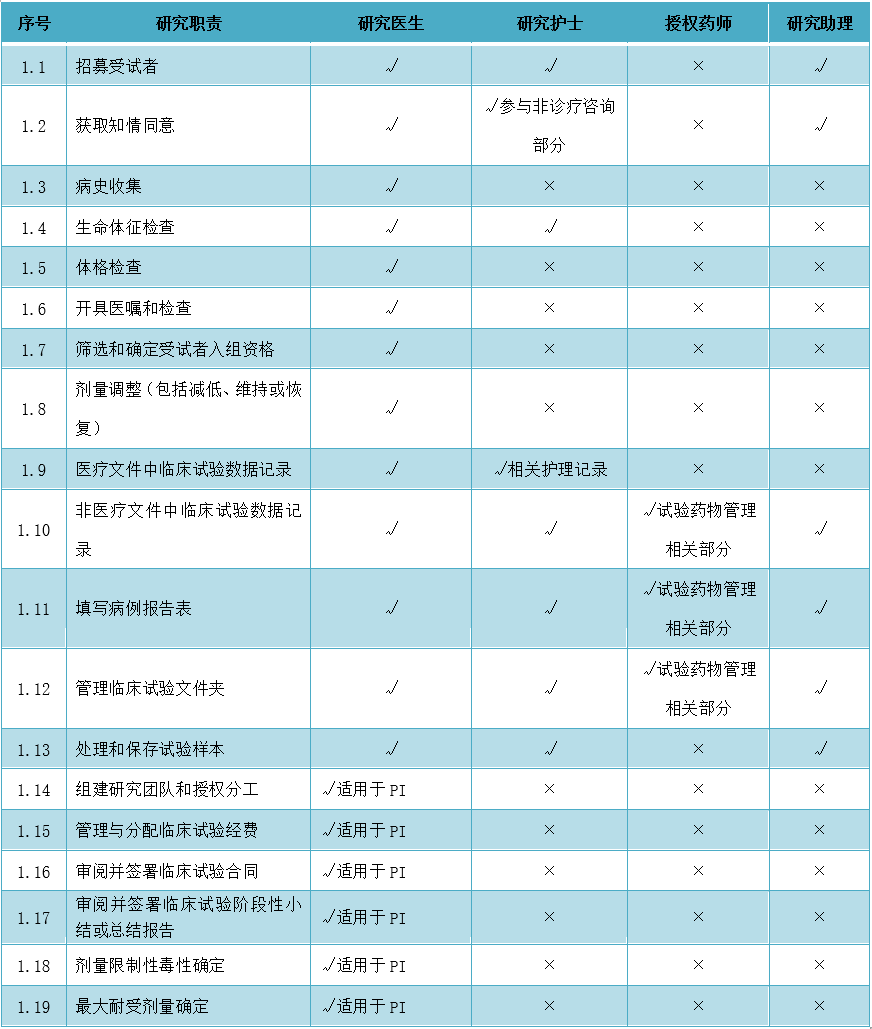
10、研究团队授权与任务外包主要内容解读
在临床试验中,授权通常是指把不同的任务和权力分派给不同人员、建立起一个对结果负责的系统的过程。一般情况下,申办者委托药物临床试验机构/主要研究者承担试验项目后,PI会把任务分派给机构中的不同人员来负责,以授权分工表形式进行团队内部人员授权,旨在结合源文件溯源流程。根据被授权人员的资质,拟授权承担的临床试验对应任务,授权其相应的研究角色,《药物临床试验 研究团队授权与任务外包·广东共识(2020年版)》建议临床试验任务授权明细可参见以下范例:
临床试验-常规事务职责授权建议范例
三、广东省药学会药物临床试验专业委员会背景知识
广东省是国内最早开展药物临床试验的省份之一,我国虽然试验机构众多,但其研究水平和管理水平则参差不齐,很多临床试验在试验设计、执行状况、质量控制以及研究结果发表等诸多方面均存在较多缺陷。因此,顺应全球药物临床试验的发展潮流,2010年11月25日广东省药学会成立广东省药学会药物临床试验专业委员会,为分布在医院、研究机构、企业以及管理部门涉及药物临床试验的人员提供一个相互交流、共享信息、共同提高、服务大众的平台。2020版《药物临床试验质量管理规范》(2020年7月1日)实施后,广东省率先组织医疗专业人士起草制定或更新《药物临床试验 制度建设·广东共识(2020年版)》等10个共识,献礼专委会成立十周年,供各医疗机构和临床试验相关方参考,2020年发布的10个共识清单如下:
1.《药物临床试验 制度建设·广东共识(2020年版)》
2.《药物临床试验 文档目录·广东共识(2020年版)》
3.《药物临床试验 CRC管理·广东共识(2020年版)》
4.《药物临床试验 安全评价·广东共识(2020年版)》
5.《药物临床试验 监查稽查·广东共识(2020年版)》
6.《药物临床试验 伦理审查·广东共识》(2020年版)》
7.《药物临床试验 受试者隐私保护·广东共识(2020年版)》
8.《药物临床试验 药物管理·广东共识(2020年更新版)》
9.《药物临床试验 质量管理·广东共识(2020年版)》。
10.《药物临床试验 研究团队授权与任务外包·广东共识(2020年版)》
参考文献
[1] www.sin·pharmacy.c·m.cn
[2] 国际药品检查动态研究2018年2月第3卷
[3] www.yydbzz.c·m/article/2016/1004-0781/1004-0781-35-zk-191.shtml
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57