为推进《药品注册管理办法》(国家市场监督管理总局令第27号,2020年7月1日实施)相关配套规范性文件、技术指导原则起草制定工作,在国家药监局的部署下,2020年12月11日,国家药品监督管理局药品审评中心(CDE)正式发布《药物研发与技术审评沟通交流管理办法》的通告(2020年第48号),自发布之日起实施(成文时间2020年12月10日),这是CDE为落实中办、国办《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号)和《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)**,为响应国务院提出的"放管服"便民政策,让数据多跑路,让MAH少跑腿,药品审评中心(CDE)深入推进药品审评制度改革,加强药品审评技术沟通交流,不断完善技术咨询平台,提高沟通交流的质量和效率,助推药品审评工作改革和发展,本文梳理了药物研发与技术审评中"沟通交流"机制相关知识点和注意点。
一、"沟通交流"的重要性
药物研发与技术审评中所指的沟通交流,系指在药物研发与注册申请技术审评过程中,申请人与药审中心审评团队就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流。沟通交流会议经申请人提出,由药审中心项目管理人员(以下简称项目管理人员)与申请人指定的药品注册专员共同商议,并经药审中心审评团队同意后召开。
众所周知,在药物研发与技术审评中有很多"非技术性"的发补和退审,与国家药监局CDE的沟通是至关重要的,CDE工作职能之一是组织开展相关业务咨询服务及学术交流,故沟通交流管理办法则提供了一个企业可以主动和CDE沟通的平台。如果药物研发与技术审评中不能很好的与CDE审评老师进行有效的沟通,可能导致药品注册的失败,为了让药品尽快上市,药品申请人自然希望与CDE反复进行沟通,以便更好理解技术审评的要求,但CDE有审评时限的要求,通过沟通交流,不仅有利于申请人提高申报效率,也可以减少CDE做低水平的重复工作,而把有限的审评资源用于更重要的技术审评上,从这个意义而言,沟通交流是双方共赢的事情。
二、"沟通交流"政策知多少?
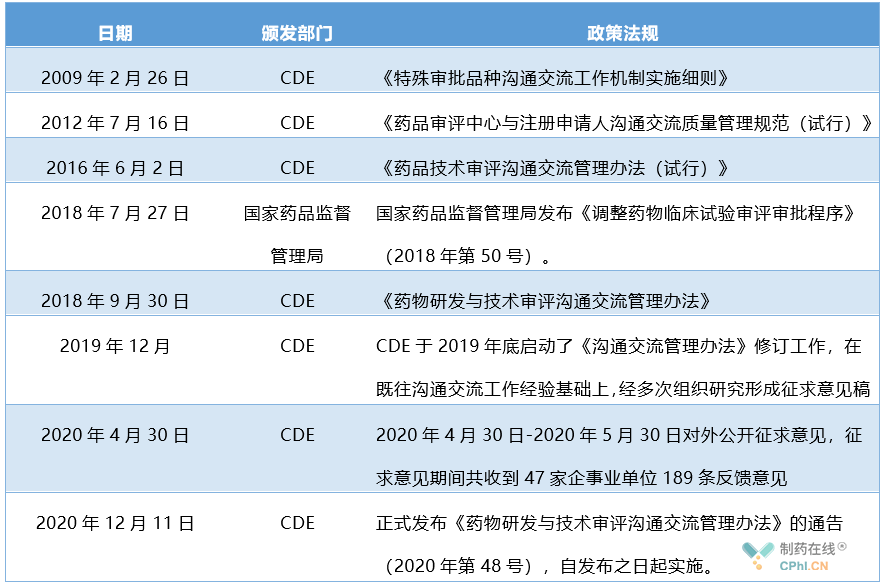
我国药物研发与技术审评中"沟通交流"机制发展比较滞后,2009年2月26日药品审评中心发布了《特殊审批品种沟通交流工作机制实施细则》,但该规范只规定了特殊审批品种沟通机制的方向,缺少指导性和实用性,直到2018年9月30日药品审评中心发布《药物研发与技术审评沟通交流管理办法》,在实用性和指导性上有了很大改善,规定了"沟通交流"机制申请流程、时限和资料要求。
我国"沟通交流"机制法规发展史
三、新版《药物研发与技术审评沟通交流管理办法》亮点抢先看
CDE从药物研制规律和注册要求出发,本着有利于药品注册申请人的原则,对沟通交流管理机制进行了修订,主要修订内容包括以下几个方面:
3.1 沟通交流程序进行调整和优化
CDE结合既往沟通交流工作中发现的问题,对沟通交流程序进行了优化,采取将《沟通交流会议申请表》和《沟通交流会议资料》由分开提交改为同时提交等措施,以进一步提升沟通交流工作质量和效率。药物研发与技术审评中沟通交流的形式包括:沟通交流会议(面对面会议、视频会议、电话会议)或书面回复。
3.2 优化和细化沟通交流情形
为鼓励创新,更好地体现沟通交流的服务属性,在保证受试者安全性的基础上,将Ⅱ类会议划分为依法应沟通交流、原则上应当沟通交流、可以沟通交流三类情形,并根据《药品注册管理办法》等相关规定将三类沟通交流的情形和要求进行了明确和细化。

3.2.1 沟通交流会议召开时间

3.3 统一和细化沟通交流要求
药品审评中心(CDE)及时发布"沟通交流"新渠道,让数据多跑路,让药企少跑腿,深入推进药品审评制度改革,向申请人提供更方便快捷的咨询服务,有效加强与申请人间沟通交流。将《关于调整药物临床试验审评审批程序的公告》(2018年第50号)、《突破性治疗药物工作程序(试行)》、《药品附条件批准上市申请审评审批工作程序(试行)》等文件中关于沟通交流的有关要求进行了梳理,统一汇总至本办法之中,并进行了明确。如在第七条中明确规定申请附条件批准和/或适用优先审评审批程序的,应与药审中心沟通交流确认后,方可向国家药品监督管理局递交药品上市许可申请。
参考文献
[1] www.cde.org.cn
[2] www.sohu.com/a/308056041_100207083
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57