2019年9月6日,国家药品监督管理局药品审评中心(CDE)官网发布《关于做好技术咨询提高服务质量的通知》,各药品注册朋友圈、网络平台被CDE这则消息疯狂刷屏,为响应国务院提出的"放管服"便民政策,让信息多跑路,让企业和群众少跑腿,药品审评中心(CDE)深入推进药品审评制度改革,加强药品审评技术沟通交流,不断完善技术咨询平台,提高沟通交流的质量和效率,助推药品审评工作改革和发展,本文梳理了药物研发与技术审评中"沟通交流"机制相关知识点。
一、"沟通交流"为何物?
药物研发与技术审评中所指的沟通交流,系指在药物研发过程中,经申请人提出,由药审中心项目管理人员与申请人指定的药品注册专员共同商议,并经药审中心适应症团队同意,就现行药物研发与评价指南不能涵盖的关键技术等问题所进行的沟通交流。
二、"沟通交流"政策知多少?
2.1 "沟通交流"机制法规篇
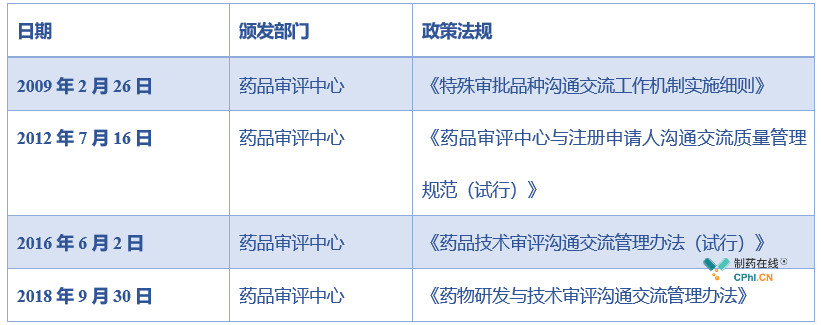
我国药物研发与技术审评中"沟通交流"机制发展比较滞后,2009年2月26日药品审评中心发布了《特殊审批品种沟通交流工作机制实施细则》,但该规范只规定了特殊审批品种沟通机制的方向,缺少指导性和实用性,直到2018年9月30日药品审评中心发布《药物研发与技术审评沟通交流管理办法》,在实用性和指导性上有了很大改善,规定了"沟通交流"机制申请流程、时限和资料要求。
我国"沟通交流"机制法规发展历史
2.2 沟通交流的形式
药物研发与技术审评中沟通交流的形式包括:
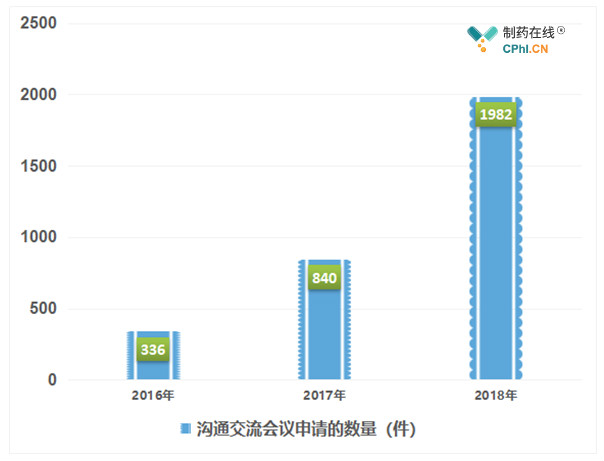
沟通交流会议(面对面会议、视频会议、电话会议)或书面回复。随着我国医药产业研发水平不断提高,创新药申报数量迅速增加,CDE公布的沟通交流会议申请的数量也爆发式增长,2016年申请的数量为336件,2017年申请的数量为840件(同比增长150%),2018年申请的数量为1982件(同比增长136%)。
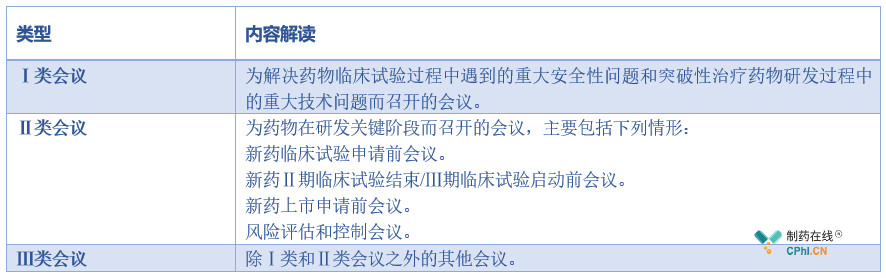
2.3 沟通交流会议类型
沟通交流会议分为Ⅰ类、Ⅱ类和Ⅲ类会议。
2.4 沟通交流会议资料递交时间

2.5 沟通交流会议召开时间

三、"沟通交流"新渠道有哪些?
2019年9月6日,国家药品监督管理局药品审评中心(CDE)官网发布《关于做好技术咨询提高服务质量的通知》通知,明确了以下三项沟通交流渠道。
3.1 设立便民查询台
在国家药品监督管理局药品审评中心(北京市朝阳区建国路128号)一楼受理大厅设立查询台,配置查询电脑,方便申请人查询或上传资料。
3.2 设立面对面咨询窗口
在国家药品监督管理局药品审评中心(北京市朝阳区建国路128号)一楼受理大厅设立面对面咨询窗口,自2019年9月9日起,每周一、三、五上午对外咨询,由项目管理人员轮流值班,协调全中心审评资源实时解决申请人相关技术咨询问题。
3.3 建立书面发补沟通交流通道
为进一步明确审评技术要求,如申请人对书面补充资料要求有疑问,可在接到书面补充通知10日内通过申请人之窗按"发补资料相关问题"提出一般性技术问题咨询申请,由项目管理人员协调适应症团队在15日内以书面或会议方式完成答复,需要召开会议的,原则上以电话会议形式进行。
四、"沟通交流"重要性
众所周知,在药物研发与技术审评中,与国家药监局CDE的沟通是至关重要的,如果药物研发与技术审评中不能很好的与CDE审评老师进行有效的沟通,可能导致药品注册的失败,为了让药品尽快上市,药品申请人自然希望与CDE反复进行沟通,以便更好理解技术审评的要求,但CDE有审评时限的要求,通过沟通交流,不仅有利于申请人提高申报效率,也可以减少CDE做低水平的重复工作,而把有限的审评资源用于更重要的技术审评上,从这个意义而言,沟通交流是双方共赢的事情。
药品审评中心(CDE)及时发布"沟通交流"新渠道,让信息多跑路,让企业和群众少跑腿,深入推进药品审评制度改革,向申请人提供更方便快捷的咨询服务,有效加强与申请人间沟通交流。
参考文献
[1] www.cde.org.cn/news.do?method=viewInfoCommon&id=314927
[2] www.sohu.com/a/308056041_100207083
[3] www.dxy.cn/bbs/thread/36028847#36028847
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业,希望在知识的海洋里,用简单的语言讲述不简单的专业知识,提供一枚知识的指南针,指引读者到达知识的彼岸。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57