制药人快来,全国制药装备标准化技术委员会喊你提意见啦!近日,笔者检索全国标准信息公共服务平台,发现全国制药装备标准化技术委员会组织编写的《制药机械(设备)计算机化系统验证指南》正在征求意见阶段,此验证指南落实国家食药监总局发布《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证两个附录的公告(2015年第54号)等文件**,据报道该验证指南于2020年6月底完成立项草稿,2021年5月修改和完善了草稿,目前正在按照专家的意见修改后征求意见。本文为大家梳理了2020版《制药机械(设备)计算机化系统验证指南》关键要点内容并结合自己的解读与大家分享。
一、制药设备计算机化系统验证的痛点
随着药政监管力度的加强和新版中国GMP的实施,特别是国家食药监总局发布《药品生产质量管理规范(2010年修订)》计算机化系统和确认与验证两个附录的公告(2015年第54号),对制药企业计算机系统验证提出了更高的要求,明确了计算机系统验证应该贯穿于计算机化系统生命周期的全过程。在中国药企进入国际市场时,需要提高验证水平。而国内制药企业在计算机验证时,可供参考的实际案例较为缺乏,系统验证管理水平还较低。因此,明确计算机验证的流程和方法,尽快提升计算机验证水平,是目前亟待解决的问题。目前,国内外关于制药装备计算机化系统验证尚未有统一的技术标准,国外ISPE GAMP5(Good Automated Manufacturing Practice -Rev5良好自动化生产实践指南第五版)对计算机化系统相关建议和要求做了详细说明,但未形成标准。国内除2015年实施的计算机化系统和验证两个附录外,再无相关专用技术规范。
二、制药设备计算机化系统验证活动概述
1、制药设备计算机化系统验证4大关键步骤
制药设备计算机化系统从立项到退役的整个生命历程,通常分为四个主要阶段:系统立项、系统实施、系统运行、系统退役。
2、步骤一:系统立项
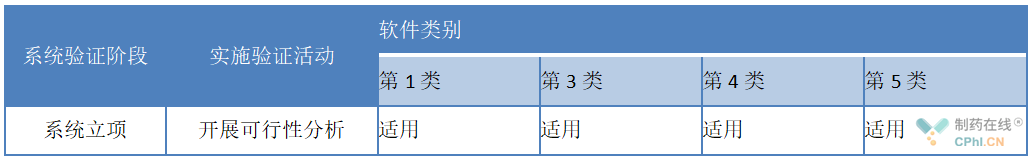
备注:软件类别详见4.2项下系统软件分类示例。
立项的活动主要取决于验证方提出并确认系统启动的方案。通常,在这个阶段宜提出初始需求并考虑可能的解决方案。通过对系统验证范围、成本和收益的初步评估,来决定是否需要进入到系统实施阶段。
3、步骤二:系统实施
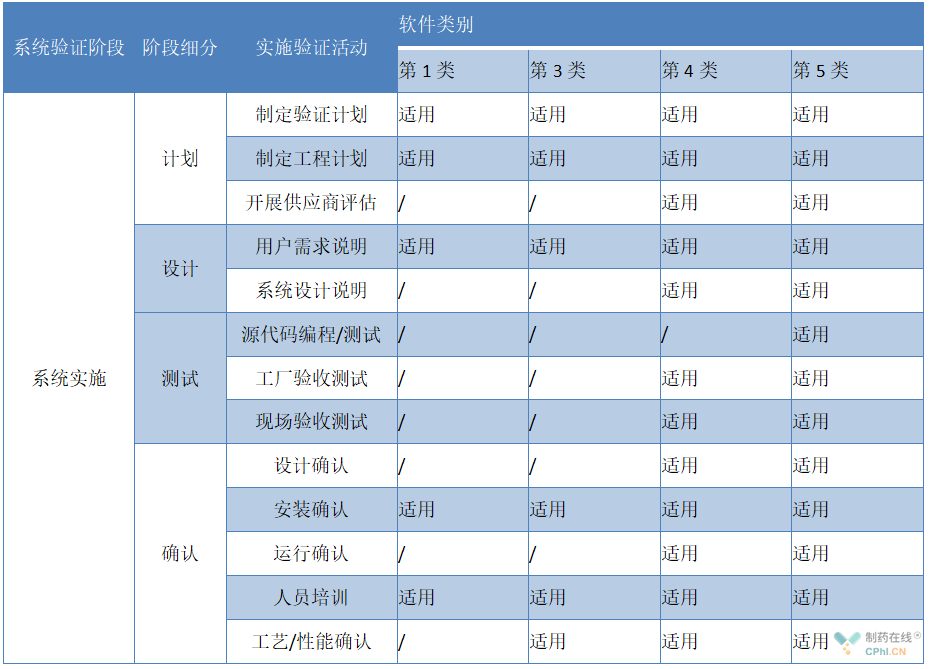
3.1计划阶段
3.1.1制定验证计划:验证计划宜包含系统描述、法律法规、验证的组织结构及职责分配、验证方案、验证的范围和技术要求以及项目交付物等文件。
3.1.2 制定实施计划:制定系统实施进度表,确定系统实施各阶段工作的内容及要求,确保系统在预定期限内交付,宜包含项目实施进度表等相关文件。
3.1.3 开展供应商评估:宜对供应商的供应体系或服务及其质量体系进行评估并记录。该评估的范围和程度需基于风险管理原则,提供供应商评估相关文件。
3.2 设计阶段
3.2.1 用户需求说明(URS)
设备供应商在合理范围内尽量满足用户需求,比如硬件设备的型号、品牌,软件系统功能、数据追溯、数据存储备份、电子签名以及报警触发机制和处理方式等内容。通过需求追溯矩阵(RTM)确认是否满足用户需求,宜提供需求追溯矩阵等相关文件。
3.2.2 系统设计说明
包括硬件设计说明(HDS)、软件设计说明(SDS)。
3.3测试阶段
3.3.1源代码编程/测试
3.3.2工厂验收测试(FAT)
旨在确保设备组装调试完成后能正常运行并能满足功能设计需求,宜制定针对设备计算机化系统的工厂验收测试计划,对计算机化系统相关的设备硬件和控制系统的功能进行逐一确认,如用户方无法到现场进行相关测试,可以委托实施方进行测试,记录测试结果并编制测试报告。
3.3.3现场验收测试(SAT)
旨在确认设备在运输过程中相关设备是否完好,控制系统是否能正常工作,现场验收测试的内容与工厂验收测试内容基本一致,并包括在工厂不具备测试条件的内容。
3.4确认阶段
3.4.1设计确认(DQ)
旨在确认供应商所提供的计算机化系统设计和相关配置是否符合制药企业预期要求和功能需求,主要确认内容宜包含以下三部分:
a)确认硬件设计说明(HDS)和软件设计说明(SDS)是否已完成;
b)确认系统功能设计是否符合URS要求。
c)设计确认完成后,宜制定设计确认总结报告,总结设计确认测试结果是否已达到验收标准,对于不能满足的项目宜进行偏差处理。
3.4.2安装确认(IQ)
旨在确认计算机化系统相关的软硬件设备已经安装到位,并且硬件设备型号和软件组态版本符合用户需求,主要确认内容宜包含:
a)测试前提条件确认;
b)硬件设备品牌、型号、数量和安装位置确认;
c)软件组态安装版本和位置确认;
3.4.3运行确认(OQ)
旨在确认系统功能是否符合预期要求,能在预期范围内正常运行并可正确执行相应的操作,确认内容宜包含以下内容:
a)软件版本记录:便于系统版本控制;
b)系统功能测试:
1)确认系统功能可以正常使用,比如程序是否可以正常执行;
2)参数设置可以适当程度的进行挑战性测试(如边界,范围,限制,无效输入测试);
c)数据完整性测试:
1)用户管理确认;
2)用户注销确认;
3)电子签名确认;
4)系统权限确认;
5)审计追踪数据确认;
6)系统安全性确认;
7)电子记录一致性确认;
8)时钟确认;
9)系统备份/恢复测试;
10)数据不可更改。
3.4.4人员培训
在系统发布之前宜对相关操作人员进行培训,并界定系统的使用和控制,使相关人员正确理解系统逻辑和功能。
3.4.5性能确认(PQ)
旨在确认系统运行过程的可控性、稳定性和有效性是否满足期望。性能确认方案宜包括以下内容:
a)在负载运行条件下,对药品生产要求的适应性;
b)生产能力;
c)药品生产质量相关指标;
d)运行结果的重复性;
e)控制精度准确性;
f)安全性能;
g)负载运行的可靠性试验;
h)其它所需的挑战性试验;
4、步骤三:系统运行
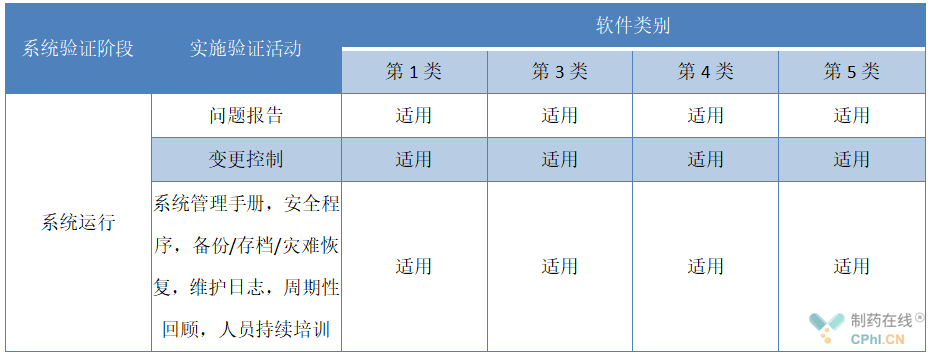
4.1问题报告
制药设备计算机化系统使用过程中出现对产品质量或数据完整性等产生影响的事件,宜评估事件的影响,并根据情况制定处理方法。对问题进行记录,编制问题报告。
4.2变更控制
变更申请宜经过审查,宜基于风险评估来确定此项变更的可实施性,实施和审核变更所需的活动进行详细的描述,变更的范围以及此项变更受影响的控制项目,建议变更所产生的影响和是否需要进一步的风险评估。变更的记录宜包含以下内容:
1)变更的分类:软件或硬件变更;
◆系统软件分类示例如下表:
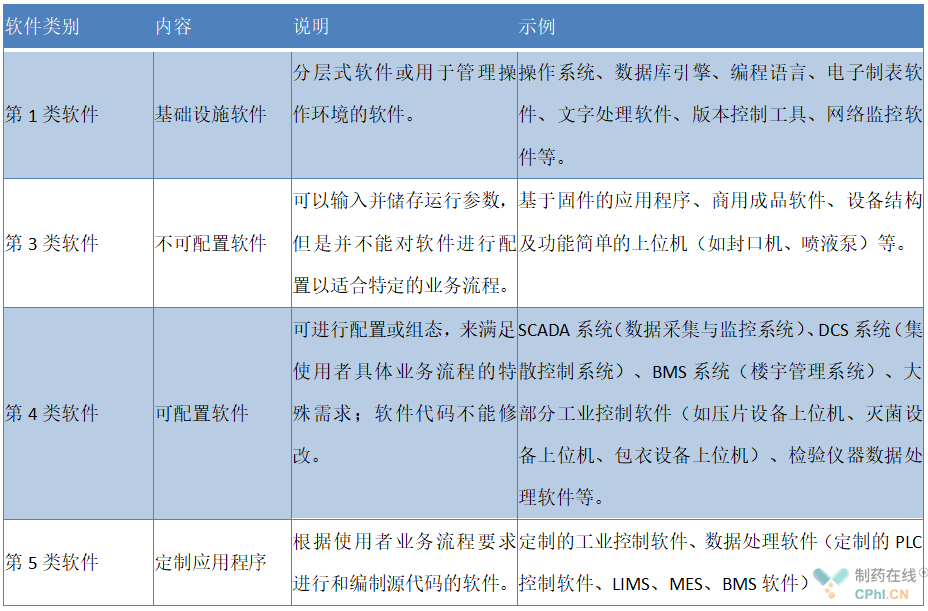
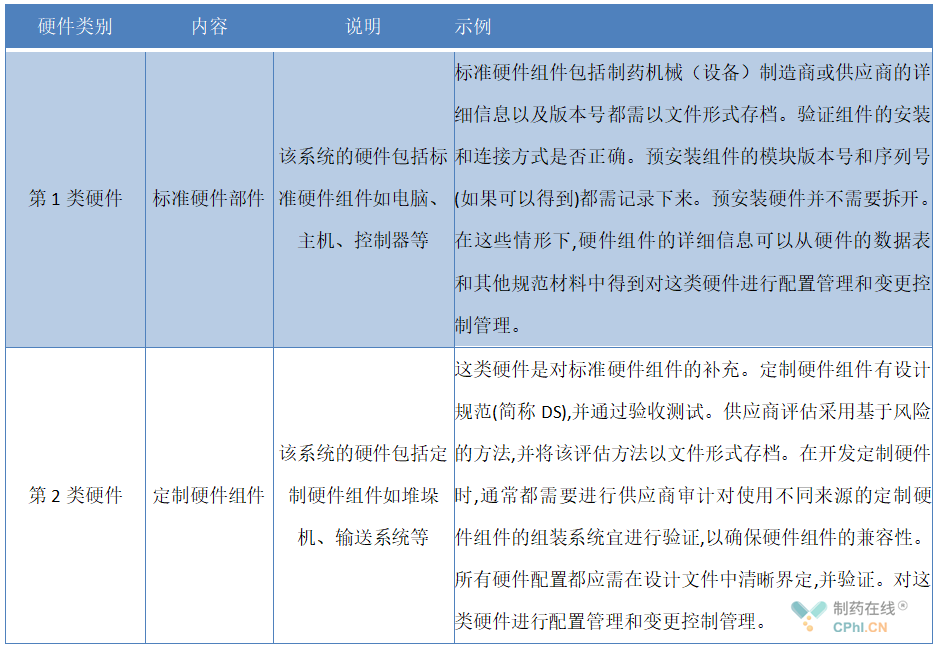
◆系统硬件分类示例如下表:
2)变更的职责划分:包括变更起草、评估、审核、批准;
3)变更管理:变更都宜处于控制下,并以文件形式存档。
4.3系统管理
制药设备计算机化系统正式使用后宜对系统进行合理管理,以确保设备可正常持续运行,宜包含以下内容:
1)人员持续培训:定期对操作人员进行培训,以确保可熟练使用设备;
2)系统管理手册:制定系统使用说明,以及系统备份/存档/灾难恢复操作等;
3)系统维护日志:当对系统进行升级或其它改动时宜有维护日志,说明原因;
4)周期性回顾:确保设备性能始终保持初始验证状态,且能满足使用需求。
5、步骤四:系统退役
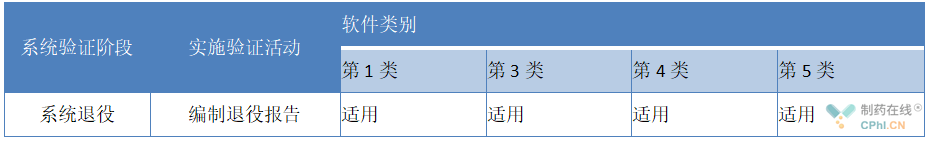
制药设备计算机化系统退役是生命周期的一部分,该阶段决定是对数据进行保留、迁移还是销毁,宜对这些过程进行管理,宜包含以下内容:
1)制定退役计划:一旦不再需要计算机化系统或其组件时,系统或组件宜按照已建立经批准的程序进行退役;
2)记录保存:确保全生命周期内记录的可读性,并保持原电子记录的内容和含义;
3)制定退役报告:退役活动的结果,包括数据和计算机化系统的可追溯性,宜呈现在报告中。
参考文献
[1]http://std.samr.gov.cn/



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57